메탄올
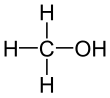
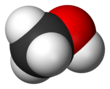
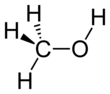
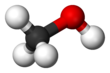
메탄올(영어: methanol, 독일어: Methanol), 화학식 CH3OH), 메틸알코올, 목정(木精)은 가장 간단한 알코올 화합물로 무색의 휘발성, 가연성, 유독성 액체이다. 메탄올은 극성 분자이고,[17] 수소 결합을 한다.[18]
| |||
| |||

| |||
| 이름 | |||
|---|---|---|---|
| 발음 | /ˈmɛθənɒl/ | ||
| 우선명 (PIN)
Methanol[1] | |||
| 별칭
Carbinol
Columbian spirits Hydroxymethane MeOH Methyl alcohol Methyl hydroxide Methylic alcohol Methylol Methylene hydrate Pyroligneous spirit Wood alcohol Wood naphtha Wood spirit | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| 3DMet | |||
| 1098229 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.599 | ||
| EC 번호 |
| ||
| 449 | |||
| KEGG | |||
| MeSH | Methanol | ||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | 1230 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| CH 3OH or CH 4O | |||
| 몰 질량 | 32.04 g mol−1 | ||
| 겉보기 | 무색 액체 | ||
| 냄새 | Sweet and pungent | ||
| 밀도 | 0.792 g/cm3[2] | ||
| 녹는점 | −97.6 °C (−143.7 °F; 175.6 K) | ||
| 끓는점 | 64.7 °C (148.5 °F; 337.8 K) | ||
| 혼화성 | |||
| log P | −0.69 | ||
| 증기 압력 | 13.02 kPa (at 20 °C) | ||
| 산성도 (pKa) | 15.5[3] | ||
| 짝산 | Methyloxonium[4] | ||
| 짝염기 | Methanolate[5] | ||
자화율 (χ)
|
−21.40·10−6 cm3/mol | ||
굴절률 (nD)
|
1.33141[6] | ||
| 점도 | 0.545 mPa·s (at 25 °C)[7] | ||
| 1.69 D | |||
| 위험[12][13] | |||
| 주요 위험 | Methanol and its vapours are flammable.
Moderately Toxicity for small animals – Highly Toxicity to large animals and humans — May be fatal/lethal or cause blindness and damage to the liver, kidneys, and heart if swallowed – Toxicity effects from repeated over exposure have an accumulative effect on the central nervous system, especially the optic nerve – Symptoms may be delayed, become severe after 12 to 18 hours, and linger for several days after exposure[9] | ||
| 물질 안전 보건 자료 | [1] | ||
| GHS 그림문자 |    [8] [8]
| ||
| 신호어 | 위험[8] | ||
| H225, H301, H311, H331, H370[8] | |||
| P210, P233, P240, P241, P242, P243, P260, P264, P270, P271, P280, P301+330+331, P310, P302+352, P312, P303+361+353, P304+340, P311, P305+351+338, P307+311, P337+313, P361, P363, P370+378, P403+233[8] | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | 11 to 12 °C (52 to 54 °F; 284 to 285 K) | ||
| 470 °C (878 °F; 743 K)[15] 385 °C (725 °F; 658 K)[16] | |||
| 폭발 한계 | 6–36%[10] | ||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LD50 (median dose)
|
5628 mg/kg (rat, oral) 7300 mg/kg (mouse, oral) 12880 mg/kg (rat, oral) 14200 mg/kg (rabbit, oral)[11] | ||
LC50 (median concentration)
|
64,000 ppm (rat, 4 h)[11] | ||
LCLo (lowest published)
|
33,082 ppm (cat, 6 h) 37,594 ppm (mouse, 2 h)[11] | ||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용)
|
TWA 200 ppm (260 mg/m3)[10] | ||
REL (권장)
|
TWA 200 ppm (260 mg/m3) ST 250 ppm (325 mg/m3) [skin][10] | ||
IDLH (직접적 위험)
|
6000 ppm[10] | ||
| 관련 화합물 | |||
관련 화합물
|
메탄티올 Silanol 에탄올 | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
메탄올은 혐기성 생물의 대사 과정에서 자연적으로 만들어지기도 한다. 조금 마시면 눈이 멀고, 많이 마시면 사망에 이르는 경우도 있다.
제법
편집천연가스 또는 코크스로 가스 중의 메탄을 산소, 수증기와 함께 일산화탄소와 수소로 구성된 합성가스로 만든 후, 이것을 다시 촉매에서 반응시켜 메탄올로 만든다. 일반적인 용도는 포르말린 제조에 주로 사용되며 각종 에스테르류와 할로겐화물 외에 아세트산의 제조에도 쓰인다.
혈구염색과 메탄올
편집혈구들을 살아 있는 상태로 유지하기 위해서 혈구 관찰 시 슬라이드 글라스에 메틸알코올을 가하는데, 이것을 고정이라고 하며, 특히 백혈구의 고정에 용이하다.
메탄올과 에탄올
편집에탄올과 메탄올은 알코올이라는 같은 부류의 물질이며, 성질이 비슷하다. 단지, 메탄올이 에탄올에 비해 탄소와 수소를 적게 포함하고 있기 때문에 메탄올의 끓는점이 에탄올보다 낮다. 따라서, 물과 메탄올이 섞여 있는 혼합물의 분리도 분별 증류를 이용하면 된다. 메탄올은 약 64 °C에서 그래프가 일정해지면서 메탄올이 먼저 나오며, 100 °C에서 물이 끓어 나오게 된다. 반면, 물과 에탄올의 분리에서는 에탄올이 약 78 °C 정도에서 끓어 나오며, 물은 100 °C에서 끓어 나온다. 메탄올의 연소 반응은 다음과 같다.
- 2CH3OH (l) + 3O2 (g) → 2CO2(g) + 4H2O (l)
또한 메탄올은 인체 내에 흡수 시, 간에서 폼알데하이드라는 물질로 변환되어 인체에 치명적인 반면, 에탄올은 인체 내에 흡수되어 아세트알데하이드라는 독성이 상대적으로 적은 물질로 변화하여 음용이 가능하다. 에탄올은 술의 기본적인 원료로 쓰인다. 반면 메탄올은 알코올 램프 연료 및 화공 약품, 용제로 주로 쓰인다.
독성
편집메탄올은 인체 내에 흡수 시, 폼알데하이드라는 물질로 변환되어 인체에 치명적이다. 사망에 이를 수 있으며, 실명 구토 어지러움 등의 증상이 나타난다. WHO 필수 의약품 목록에 있는 포메피졸(en:Fomepizole)이라는 해독제가 있다. 만일 실수로 메탄올을 섭취했고 포메피졸을 구할 수 없는 경우 응급 처치로 다량의 에탄올을 투여하면 된다. 즉, 술을 약간 마시면 된다. 그 이유는 에탄올과 메탄올이 신체 내부로 동시에 유입되면 에탄올이 먼저 분해되며 섭취된 메탄올은 에탄올이 분해될 때까지 분해되지 않고 유지되다가 그대로 노폐물이 되어 신체 외부로 배출되기 때문이다.
용도
편집- 전자제품 칩 제조 및 식각에 이용된다.
- 폐수처리에 이용된다.
- 바이오디젤 생산에 이용된다.
- 석유, 화학, 식품공업에 이용된다.
같이 보기
편집각주
편집- ↑ 《Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)》. Cambridge: The Royal Society of Chemistry. 2014. 692쪽. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ↑ Lide, D. R., 편집. (2005). 《CRC Handbook of Chemistry and Physics》 86판. Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Ballinger, P.; Long, F. A. (1960). “Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds”. 《J. Am. Chem. Soc.》 82 (4): 795–798. doi:10.1021/ja01489a008.
- ↑ “Methyloxonium”. 《pubchem.ncbi.nlm.nih.gov》. 2018년 12월 21일에 확인함.
- ↑ “Methanolate”. 《pubchem.ncbi.nlm.nih.gov》. 2018년 12월 21일에 확인함.
Methoxide is an organic anion that is the conjugate base of methanol. … It is a conjugate base of a methanol.
- ↑ “RefractiveIndex.INFO - Refractive index database”.
- ↑ González, Begoña (2007). “Density, dynamic viscosity, and derived properties of binary mixtures of methanol or ethanol with water, ethyl acetate, and methyl acetate at T = (293.15, 298.15, and 303.15) K”. 《The Journal of Chemical Thermodynamics》 39 (12): 1578–1588. doi:10.1016/j.jct.2007.05.004.
- ↑ 가 나 다 라 “Methanol” (PDF). 《Lab Chem》. Valtech. 2016년 3월 10일에 원본 문서 (PDF)에서 보존된 문서. 2016년 3월 10일에 확인함.
- ↑ Toxicity on PubChem
- ↑ 가 나 다 라 NIOSH Pocket Guide to Chemical Hazards. “#0397”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ 가 나 다 “Methanol”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 가 나 “The Emergency Response Safety and Health Database: Systematic Agent: METHANOL”. Centers for Disease Control and Prevention. 2018년 8월 3일에 확인함.
- ↑ “PubChem: Safety and Hazards - GHS Classification”. National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ “Methanol Safe Handling Manual” (PDF). 《Methanol Institute》. 2017. 253쪽. 2018년 8월 3일에 확인함.
- ↑ “Technical Information & Safe Handling Guide for Methanol”. Methanex Corporation. 2012년 3월 11일에 원본 문서에서 보존된 문서.
- ↑ “Methanol Safe Handling Manual” (PDF). 《Methanol Institute》. 2017. 243쪽. 2018년 8월 3일에 확인함.
- ↑ 김봉래 외 2 (2006년 7월 1일). 《완자 화학 Ⅰ(1권)》 초판. 비유와상징. 9쪽.
- ↑ 화학용어사전편찬회. 《화학용어사전》. 일진사.
외부 링크
편집- 위키미디어 공용에 메탄올 관련 미디어 분류가 있습니다.