브로민화 수소
브로민화 수소(영어: hydrogen bromide, HBr)는 상온 상태에서는 무색의 기체이다. 물에 용해하면 브로민화 수소산을 얻게 되고, 반대로 탈수제(脫水劑)의 첨가를 통해 기체를 추출해낼 수도 있지만, 수소산이 용해된 물을 단순히 증류시키는 방법으로는 같은 효과를 기대할 수 없다.
| |||
| |||
| 이름 | |||
|---|---|---|---|
| 우선명 (PIN)
Hydrogen bromide | |||
| 체계명
Bromane[1] | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| 3587158 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.030.090 | ||
| EC 번호 |
| ||
| KEGG | |||
| MeSH | Hydrobromic+Acid | ||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | 1048 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
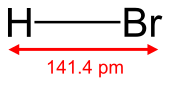
| HBr | |||
| 몰 질량 | 80.91 g/mol | ||
| 겉보기 | Colorless gas | ||
| 냄새 | Acrid | ||
| 밀도 | 3.6452 kg/m3 (0 °C, 1013 mbar)[2] | ||
| 녹는점 | −86.9 °C (−124.4 °F; 186.2 K) | ||
| 끓는점 | −66.8 °C (−88.2 °F; 206.3 K) | ||
| 221 g/100 mL (0 °C) 204 g/100 mL (15 °C) 193 g/100 mL (20 °C) 130 g/100 mL (100 °C) | |||
| 용해도 | Soluble in alcohol, organic solvents | ||
| 증기 압력 | 2.308 MPa (at 21 °C) | ||
| 산성도 (pKa) | −8.8 (±0.8);[3] ~−9[4] | ||
| 염기도 (pKb) | ~23 | ||
| 짝산 | Bromonium | ||
| 짝염기 | Bromide | ||
굴절률 (nD)
|
1.325 | ||
| 구조 | |||
| Linear | |||
| 820 mD | |||
| 열화학 | |||
열용량 (C)
|
350.7 mJ/(K·g) | ||
표준 몰 엔트로피 (S
|
198.696–198.704 J/(K·mol)[5] | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
−36.45...−36.13 kJ/mol[5] | ||
| 위험 | |||
| 물질 안전 보건 자료 | hazard.com | ||
| GHS 그림문자 |  
| ||
| 신호어 | 위험 | ||
| H314, H335 | |||
| P261, P280, P305+351+338, P310 | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LC50 (median concentration)
|
2858 ppm (rat, 1 h) 814 ppm (mouse, 1 h)[7] | ||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용)
|
TWA 3 ppm (10 mg/m3)[6] | ||
REL (권장)
|
TWA 3 ppm (10 mg/m3)[6] | ||
IDLH (직접적 위험)
|
30 ppm[6] | ||
| 관련 화합물 | |||
관련 화합물
|
Hydrogen fluoride Hydrogen chloride Hydrogen iodide Hydrogen astatide | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
특징
편집브로민화 수소는 상온 상태에서는 신랄한 냄새가 나는 비휘발성 기체로, 습도 높은 공기와 접촉하면 수소산을 형성하기 시작한다. 물에 잘 녹으며, 298K에서 물에 용해하면 물 중량의 68.85%가 수소산화한 후 포화 상태가 된다. 전체 무게의 47.38%가 용해된 브롬화 수소로 구성된 물은 126 °C에서 끓는 공비 혼합물(azeotropte)이 되는데, 용해된 브로민화 수소의 비율이 더 낮을 경우 H2O는 브로민화 수소의 함유량이 47.38%에 이를 때까지 100 °C에서 계속 증발한다.
용도
편집브로민화 수소로 알코올에서 브로민화 알킬(alkyl bromide)을 추출한다.
- ROH + HBr → RBr + H2O
알켄에서 분리한 브로민을 첨가해 중요한 유기브로민 화합물(organobromine compound)의 하나인 브로모알케인(bromoalkane)을 이룬다.
- RCH=CH2 + HBr → RCHBr–CH3
알카인에 첨가하여 브로모알켄(bromoalkene)을 생산한다. 입체화학에서는 이런 류의 첨가 반응을 안티(anti)라고 한다.
- RC≡CH + HBr → RCBr=CH2
할로알켄(haloalkene)에 첨가하여 두 브로민 원자가 탄소 원자와 연결된 이중 할로알케인(dihaloalkane)을 만든다. 이런 첨가 반응은 마르코프니코프의 법칙(Markovnikov's rule)을 따른다.
- RCBr=CH2 + HBr → RCBr2–CH3
브로민화 수소는 에폭시 화합물(epoxide)이나 락톤(lactone)을 열거나 브로모아세탈(bromoacetal)을 합성하는 데에도 쓰이고, 촉매 용도로도 사용된다.[8][9][10][11]
공업용 제조
편집브로민화 수소(브로민화 수소산 포함)는 비슷한 특성을 가진 염화물(chloride)보다 훨씬 더 적은 양이 산출된다. 공업용으로는 수소와 브로민을 200-400 °C에서 대개 백금이나 석면(石綿)을 촉진제로 활용해 제조한다.[9][12]
실험용 합성
편집브로민화 수소는 여러 방법으로 합성할 수 있다. 편리한 방법의 하나는 브로민화 나트륨(NaBr)과 강산(強酸)을 이용하는 것인데[13], 생성된 브로민화 수소를 다시 산화해버리는 황산은 예외이다.
- 2 NaBr + H2SO4 → 2 Hbr + Na2SO4 과정 도중에 일어나는 2 HBr + H2SO4 → Br2 + SO2 + 2 H2O 반응으로 인해 HBr를 제대로 얻을 수 없다.
브로민화 수소를 산화하지 않는 인산(燐酸) 등은 써도 무방하다.
- 3 NaBr + H3PO4 → 3 Hbr + Na3PO4
테트랄린(tetralin - 1,2,3,4-tetrahydronaphthalene)을 사용하면 이렇게 된다.[13]
- C10H12 + 4 Br2 → C10H8Br4 + 4 HBr
- Br2 + H3PO3 + H2O → H3PO4 + 2 HBr
무수(無水)의 브로민화 수소는 환류하는 자일렌(xylene) 내 트라이페닐포스포늄(triphenylphosphonium)의 열분해(thermal decomposition)를 통해서도 소량을 생산할 수 있다.[8]
위에서 열거한 방법들의 경우 결과물이 브로민 가스(Br2)로 오염되어 있을 수 있는데, 결과가 나온 후 구리로 된 선반이나 페놀 사이로 통과시키면 문제를 해결할 수 있다.[12]
각주
편집- ↑ “Hydrobromic Acid - Compound Summary”. 《PubChem Compound》. USA: National Center for Biotechnology Information. 2004년 9월 16일. Identification and Related Records. 2011년 11월 10일에 확인함.
- ↑ Record in the GESTIS Substance Database of the Institute for Occupational Safety and Health
- ↑ Trummal, Aleksander; Lipping, Lauri; Kaljurand, Ivari; Koppel, Ilmar A; Leito, Ivo (2016). “Acidity of Strong Acids in Water and Dimethyl Sulfoxide”. 《The Journal of Physical Chemistry A》 120 (20): 3663–9. Bibcode:2016JPCA..120.3663T. doi:10.1021/acs.jpca.6b02253. PMID 27115918.
- ↑ Perrin, D. D. Dissociation constants of inorganic acids and bases in aqueous solution. Butterworths, London, 1969.
- ↑ 가 나 Zumdahl, Steven S. (2009). 《Chemical Principles 6th Ed.》. Houghton Mifflin Company. ISBN 978-0-618-94690-7.
- ↑ 가 나 다 NIOSH Pocket Guide to Chemical Hazards. “#0331”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ “Hydrogen bromide”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 가 나 Hercouet, A.;LeCorre, M. (1988) Triphenylphosphonium bromide: A convenient and quantitative source of gaseous hydrogen bromide. Synthesis, 157-158.
- ↑ 가 나 다 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements; Butterworth-Heineman: Oxford, Great Britain; 1997; pp. 809-812.
- ↑ Carlin, William W. 미국 특허 4,147,601, April 3, 1979
- ↑ Vollhardt, K. P. C.; Schore, N. E. Organic Chemistry: Structure and Function; 4th Ed.; W. H. Freeman and Company: New York, NY; 2003.
- ↑ 가 나 Ruhoff, J. R.; Burnett, R. E.; Reid, E. E. "Hydrogen Bromide (Anhydrous)" Organic Syntheses, Vol. 15, p.35 (Coll. Vol. 2, p.338).
- ↑ 가 나 WebElements: Hydrogen Bromide
외부 링크
편집- 위키미디어 공용에 브로민화 수소 관련 미디어 분류가 있습니다.


