일산화 질소
일산화 질소(一酸化窒素, 영어: nitric oxide) 또는 산화 질소(酸化窒素)는 질소와 산소로 이루어진 화합물이다. 분자식은 NO이다.
| |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
Nitrogen monoxide
| |||
| 체계명
Oxidonitrogen(•)[1] (additive) | |||
| 별칭
Nitric oxide
Nitrogen(II) oxide | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| 3DMet | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.030.233 | ||
| EC 번호 |
| ||
| 451 | |||
| KEGG | |||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | 1660 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| NO | |||
| 몰 질량 | 30.006 g·mol−1 | ||
| 겉보기 | 무색 기체 | ||
| 밀도 | 1.3402 g/L | ||
| 녹는점 | −164 °C (−263 °F; 109 K) | ||
| 끓는점 | −152 °C (−242 °F; 121 K) | ||
| 0.0098 g / 100 ml (0 °C) 0.0056 g / 100 ml (20 °C) | |||
굴절률 (nD)
|
1.0002697 | ||
| 구조 | |||
| linear (point group C∞v) | |||
| 열화학 | |||
표준 몰 엔트로피 (S
|
210.76 J/(K·mol) | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
91.29 kJ/mol | ||
| 약리학 | |||
| R07AX01 (WHO) | |||
| 라이선스 데이터 | |||
| Inhalation | |||
| 약물동태학: | |||
| good | |||
| via pulmonary capillary bed | |||
| 2–6 seconds | |||
| 위험 | |||
| 주요 위험 |
| ||
| 물질 안전 보건 자료 | External SDS | ||
| GHS 그림문자 |     [2][3] [2][3]
| ||
| 신호어 | 위험 | ||
| H270, H280, H330, H314[2][3] | |||
| P244, P260, P220, P280, P304+340+315, P303+361+353+315, P305+351+338+315, P370+376, P403, P405[2][3] | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LC50 (median concentration)
|
315 ppm (rabbit, 15 min) 854 ppm (rat, 4 h) 2500 ppm (mouse, 12 min)[4] | ||
LCLo (lowest published)
|
320 ppm (mouse)[4] | ||
| 관련 화합물 | |||
관련 질소 산화물
|
오산화 이질소 사산화 이질소 | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
성질
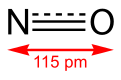
편집상온에서 무색의 기체로 존재한다. 녹는점은 -161 °C, 끓는점은 -151 °C이다. 임계 온도는 -92.9 °C, 임계 압력은 64.6atm이다. 분자의 구조는 선형인데, 질소 원자와 산소 원자 사이의 결합길이는 1.151Å으로 이중 결합일 때의 기대값과 삼중 결합일 때의 기대값의 중간이다.[5]
분자에 전자가 홀수개로 존재하는 몇 안 되는 화합물 중 하나이다. 액체 상태에서는 이합체의 형성이 일어나며, 고체 상태에서는 대부분이 이합체의 형태로 존재하나 기체 상태에서는 분자는 단독으로 존재한다. 전자의 개수가 홀수이기 때문에 전자를 얻거나 잃는 경향이 강하여 NO+, NO-과 같은 이온을 형성하기 쉽다.[6]
화학적으로 매우 반응성이 큰 물질로, 산화되어 이산화질소로 되기 쉽다. 산소가 존재할 경우 이들과 반응하여 이산화 질소가 된다. 700 °C로 가열하면 다음과 같이 분해가 시작되어 1200 °C까지 가열될 경우 60%가 분해된다.[5]
- 2NO → N2 + O2
- 4NO → 2 N2O + O2
일산화 질소가 관련된 반응 중 대표적인 것은 다음과 같다.[5]
제법
편집일산화질소는 주로 다음과 같은 방법으로 제작한다.[5]
생체 내에서의 작용
편집안전성
편집증기는 기도를 강하게 자극한다. 눈과 목에 자극, 가슴의 긴장, 두통, 구역질, 점차적인 무력함이 일어날 수 있다. 심각한 증상은 몇시간 후에도 일어날 수 있으며 청색증, 호흡 곤란, 불규칙한 호흡, 나른함이 있을 수 있다. 치료받지 않는 경우 폐수종으로 인하여 결과적으로 사망할 수 있다.[8]
피부 조직과 눈을 심하게 자극한다.[8]
각주
편집- ↑ “Nitric Oxide (CHEBI:16480)”. 《Chemical Entities of Biological Interest (ChEBI)》. UK: European Bioinformatics Institute.
- ↑ 가 나 다 “Nitrogen monoxide - Registration Dossier - ECHA”. 2020년 11월 2일에 확인함.
- ↑ 가 나 다 라 “Safety Data Sheet - Nitric Oxide, compressed - Registration Dossier” (PDF). 2020년 11월 2일에 확인함.
- ↑ 가 나 “Nitric oxide”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 가 나 다 라 化學大辭典編集委員會 편, 성용길, 김창홍 역, 〈일산화질소〉, 《화학대사전》(Vol. 7), 서울: 世和, 2001, 575쪽.
- ↑ Parker, S. P. et al., "Nitrogen oxides", McGraw-Hill encyclopedia of chemistry, New York: McGraw-Hill, 1993, pp. 701~703.
- ↑ Campbell, N. A. et al., Biology, 8th edition, San Francisco: Pearson Benjamin Cummings, 2007, p. 981.
- ↑ 가 나 “일산화 질소 MSDS” (PDF). 2006년 10월 20일에 원본 문서 (PDF)에서 보존된 문서. 2008년 6월 5일에 확인함.
외부 링크
편집- 위키미디어 공용에 일산화 질소 관련 미디어 분류가 있습니다.
참고 문헌
편집- Campbell, N. A. et al., Biology, 8th edition, San Francisco: Pearson Benjamin Cummings, 2007.
- Parker, S. P. et al., McGraw-Hill encyclopedia of chemistry, New York: McGraw-Hill, 1993.
- 化學大辭典編集委員會 편, 성용길, 김창홍 역, 《화학대사전》, 서울: 世和, 2001.
- https://web.archive.org/web/20061020030521/http://www.vngas.com/pdf/g60.pdf


