아그마틴
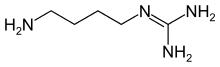
아그마틴(영어: agmatine)은 1910년에 알브레히트 코셀에 의해 발견된 아미노구아니딘이다.[2] 1-(4-아미노뷰틸)구아니딘(영어: 1-(4-aminobutyl)guanidine)으로도 알려져 있다. 아그마틴은 아르지닌으로부터 자연적으로 생성되는 화합물이다. 아그마틴은 특히 여러 분자적 표적에서 조절 작용을 하는 것으로 나타났다. 신경전달물질 시스템, 이온 통로, 일산화 질소(NO) 합성 및 폴리아민의 대사를 통해 잠재적인 응용분야에서 추가적인 연구를 위한 기반을 제공한다.
| |
| 이름 | |
|---|---|
| IUPAC 이름
1-(4-Aminobutyl)guanidine[1]
| |
| 식별자 | |
3D 모델 (JSmol)
|
|
| 3DMet | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.005.626 |
| EC 번호 |
|
| KEGG | |
| MeSH | Agmatine |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| C5H14N4 | |
| 몰 질량 | 130.195 g·mol−1 |
| 밀도 | 1.2 g/ml |
| 녹는점 | 102 °C (216 °F; 375 K) |
| 끓는점 | 281 °C (538 °F; 554 K) |
| high | |
| log P | −1.423 |
| 염기도 (pKb) | 0.52 |
| 위험 | |
| 인화점 | 95.8 °C (204.4 °F; 368.9 K) |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
역사
편집아그마틴은 1910년에 독일의 생화학자 알브레히트 코셀에 의해 발견되었다. 아그마틴은 정확한 기능을 찾는 데 100년 이상이 걸린 화합물이다. 아그마틴(agmatine)이란 용어는 a-(아미노-, amino-) + -g-(구아니딘, guanidine) + -ma-(프토마인, ptomaine) + -in(독일어)/-ine(영어) 접미사에 활음조로 -t-가 삽입되어 만들어졌다.[3] 발견된 지 1년 후, 아그마틴은 토끼에서 혈류량을 증가시킬 수 있다는 것이 발견되었다.[4] 그러나 필요로 하는 고농도(높은 μM 범위)를 고려할 때 이러한 발견의 생리적 관련성에 의문이 제기되었다.[5] 1920년대에 오스카 민코프스키의 당뇨병 클리닉 연구원들은 아그마틴이 가벼운 저혈당 효과를 발휘할 수 있다는 것을 보여주었다.[6] 1994년에 포유류에서 내인성 아그마틴의 합성이 발견되었다.[7]
대사 경로
편집아르지닌 탈카복실화에 의한 아그마틴 생합성은 주요 아르지닌 의존성 경로, 즉 질소 대사(요소 회로), 폴리아민 및 일산화 질소(NO) 합성 등과 경쟁할 수 있도록 잘 배치되어 있다. 아그마틴은 아그마티네이스에 의해 요소와 푸트레신으로 가수분해된다. 푸트레신은 폴리아민 생합성의 다이아민 전구체이다. 주로 말초 조직에 있는 대체 경로는 다이아민 산화효소에 의해 아그마틴-알데하이드로 전환되고, 이어서 알데하이드 탈수소효소에 의해 구아니디노뷰티르산으로 전환되고 콩팥에 의해 분비된다.
작용 메커니즘
편집아그마틴은 건강 및 질병에서 가장 중요한 세포 조절 메커니즘의 기초가 되는 다수의 주요 분자 표적에 직간접적으로 조절 작용을 하는 것으로 밝혀졌다. 아그마틴은 여러 표적에 동시에 조절 작용을 발휘할 수 있는 것으로 간주된다.[8] 다음의 개요는 조절 메커니즘의 범주를 나타내고 해당 분자 표적을 식별한다.
- 신경전달물질 수용체 및 수용체 이오노포어: 니코틴성 수용체, 이미다졸린 I1 수용체, 이미다졸린 I2 수용체, α2-아드레날린작동성 수용체, NMDA 수용체, 5-HT2A 수용체, 5-HT3 수용체.
- 이온 통로: ATP-민감성 K+ 통로, 전압 개폐 Ca2+ 통로, 산 감지 이온 통로(ASIC) 포함.
- 막수송 단백질: 아그마틴 특이 선택적 흡수 부위, 유기 양이온 수송체(주로 OCT2 서브타입), 신경의 모노아민 수송체(ENT), 폴리아민 수송체 및 미토콘드리아 아그마틴 특이 선택적 수송 시스템.
- 일산화 질소(NO) 합성 조절: 산화 질소 생성효소의 동질효소의 차별적 억제 및 활성화가 모두 보고됨.[9][10].
- 폴리아민 대사: 아그마틴은 폴리아민 합성의 전구체, 폴리아민 수송체의 경쟁적 저해제, 스페르미딘/스페르민 아세틸트랜스퍼레이스(SSAT)의 유도제 및 안티자임의 유도체이다.
- 단백질 ADP-리보실화: 단백질 아르지닌 ADP-리보실화의 억제.
- 매트릭스 메탈로펩티데이스(MMP): MMP2 및 MMP9의 간접적인 하향 조절.
- 최종 당화 산물(AGE)의 형성: 최종 당화 산물 형성의 직접적인 봉쇄.
- NADPH 산화효소: H2O2 생성을 유도하는 효소의 활성화.[11]
식품 섭취
편집아그마틴 황산염 주사는 탄수화물에 대한 선호로 음식 섭취를 증가시킬 수 있지만, 배고픈 쥐에서는 그렇지 않으며, 이러한 효과는 신경펩타이드 Y에 의해 매개될 수 있다.[12] 그러나 쥐에서 먹는 물을 보충시키면 수분 섭취량이 감소하고 체중이 증가하게 된다.[13] 또한 아그마틴을 강제로 먹이는 것은 쥐의 성장 과정 동안 체중 증가를 감소시킨다.[14] 많은 발효 식품에는 아그마틴이 포함되어 있다.[15][16]
약물동태학
편집아그마틴은 식물, 동물 및 어류로부터 유래한 식품에 소량으로 존재하며, 장내 미생물에 의해서도 추가로 공급된다. 구강의 아그마틴은 위장관에서 흡수되어 몸 전체로 쉽게 전달될 수 있다.[17] 콩팥에 의해 흡수된 대사되지 않은 아그마틴의 뇌 이외의 기관에서의 빠른 제거는 약 2시간의 혈액 반감기를 나타냈다.[18] 또한 아그마틴은 신경조절제이며, 이는 신경세포 사이의 정보의 화학적 전달을 조절하는 물질이라는 것을 의미한다.[8]
연구
편집아그마틴에 대한 다양한 잠재적 의료 용도가 제안되었다.[19]
심혈관계
편집아그마틴은 이미다졸린 수용체 아형, 노르에피네프린 방출 및 일산화 질소(NO) 생성을 포함한 몇 가지 분자 표적을 통해 중추신경계 및 말초신경계를 활성화시킴으로써 심박수 및 혈압을 약간 감소시킨다.[20]
혈당량 조절
편집아그마틴의 저혈당 효과는 혈당량 조절에 관여하는 여러 분자 메커니즘의 동시적인 조절의 결과이다.[8]
콩팥 기능
편집아그마틴은 사구체 여과율(GFR)을 향상시키고, 콩팥 보호 효과를 가지는 것으로 나타났다.[21]
신경전달
편집아그마틴은 신경전달물질로 추정된다고 논의되어 왔다. 아그마틴은 뇌에서 합성되고, 시냅스 소포에 저장되며, 흡수에 의해 축적되고, 막의 탈분극에 의해 방출되며 아그마티네이스에 의해 불활성화된다. 아그마틴은 α2-아드레날린작동성 수용체 및 이미다졸린 수용체의 결합 부위에 결합하고, NMDA 수용체 및 다른 양이온 리간드 개폐 이온 통로를 차단한다. 시냅스 후 특정("자신의") 수용체를 식별하는 것만으로도 아그마틴은 신경전달물질에 대한 헨리 데일의 기준을 충족하며, 따라서 신경조절물질 및 공동전달물질로 간주된다. 이러한 수용체가 중추신경계 및 말초신경계를 매개하는 데 있어서 존재할 것이라고 암시되지만, 이론적으로 아그마틴 작동성 매개 신경계의 존재는 아직 입증되지 않았다.[8] 아그마틴 특이적 수용체 및 전달 경로에 대한 연구는 계속되고 있다.
개방된 양이온 통로를 통과하는 능력으로 인해 아그마틴은 또한 자극시 신경 조직으로 통합되는 이온 플럭스의 대용 지표로도 사용되어 왔다.[22] 신경 조직이 아그마틴의 존재 하에 배양되고 외부 자극이 작용하면 개방 통로를 가진 세포 만이 아그마틴으로 채워져서 어떤 세포가 그러한 자극에 민감한지, 그리고 자극하는 동안 양이온 통로를 개방한 정도를 확인할 수 있다.
오피오이드
편집전신성 아그마틴은 오피오이드의 무통증을 강화시키고 실험실의 설치류에서 만성적인 모르핀에 대한 내성을 막을 수 있다. 그 이후로 누적된 증거는 아그마틴이 여러 동물종들에서 오피오이드 의존성과 재발을 억제한다는 것을 충분히 보여준다.[23]
같이 보기
편집각주
편집- ↑ “agmatine (CHEBI:17431)”. 《Chemical Entities of Biological Interest》. UK: European Bioinformatics Institute. 2008년 8월 15일. Main. 2012년 1월 11일에 확인함.
- ↑ Kossel A (1910). “Über das Agmatin”. 《Zeitschrift für Physiologische Chemie》 (독일어) 66 (3): 257–261. doi:10.1515/bchm2.1910.66.3.257.
- ↑ 〈agmantine〉. 《옥스퍼드 영어사전》 온라인판. 옥스퍼드 대학교 출판부. (구독 또는 참여 기관 회원가입 필요)
- ↑ Engeland R, Kutscher F (1910). “Ueber eine zweite wirksame Secale-base.”. 《Z Physiol Chem》 (독일어) 57: 49–65. doi:10.1515/bchm2.1908.57.1-2.49.
- ↑ Dale HH, Laidlaw PP (October 1911). “Further observations on the action of beta-iminazolylethylamine”. 《The Journal of Physiology》 43 (2): 182–95. doi:10.1113/jphysiol.1911.sp001464. PMC 1512691. PMID 16993089.
- ↑ Frank E, Nothmann M, Wagner A (1926). “über Synthetisch Dargestellte Körper mit Insulinartiger Wirkung Auf den Normalen und Diabetischen Organismus”. 《Klinische Wochenschrift》 (독일어) 5 (45): 2100–2107. doi:10.1007/BF01736560.
- ↑ Li G, Regunathan S, Barrow CJ, Eshraghi J, Cooper R, Reis DJ (February 1994). “Agmatine: an endogenous clonidine-displacing substance in the brain”. 《Science》 263 (5149): 966–9. doi:10.1126/science.7906055. PMID 7906055.
- ↑ 가 나 다 라 Piletz JE, Aricioglu F, Cheng JT, Fairbanks CA, Gilad VH, Haenisch B, Halaris A, Hong S, Lee JE, Li J, Liu P, Molderings GJ, Rodrigues AL, Satriano J, Seong GJ, Wilcox G, Wu N, Gilad GM (September 2013). “Agmatine: clinical applications after 100 years in translation”. 《Drug Discovery Today》 18 (17–18): 880–93. doi:10.1016/j.drudis.2013.05.017. PMID 23769988.
- ↑ Galea, Elena; Regunathan, S.; Eliopoulos, Vassily; Feinstein, Douglas L.; Reis, Donald J. (1996년 5월 15일). “Inhibition of mammalian nitric oxide synthases by agmatine, an endogenous polyamine formed by decarboxylation of arginine”. 《Biochemical Journal》 (영어) 316 (1): 247–249. doi:10.1042/bj3160247. ISSN 0264-6021. PMC 1217329. PMID 8645212.
- ↑ Gadkari TV, Cortes N, Madrasi K, Tsoukias NM, Joshi MS (November 2013). “Agmatine induced NO dependent rat mesenteric artery relaxation and its impairment in salt-sensitive hypertension”. 《Nitric Oxide》 35: 65–71. doi:10.1016/j.niox.2013.08.005. PMC 3844099. PMID 23994446.
- ↑ Demady DR, Jianmongkol S, Vuletich JL, Bender AT, Osawa Y (January 2001). “Agmatine enhances the NADPH oxidase activity of neuronal NO synthase and leads to oxidative inactivation of the enzyme”. 《Molecular Pharmacology》 59 (1): 24–9. doi:10.1124/mol.59.1.24. PMID 11125020.
- ↑ Taksande BG, Kotagale NR, Nakhate KT, Mali PD, Kokare DM, Hirani K, Subhedar NK, Chopde CT, Ugale RR (September 2011). “Agmatine in the hypothalamic paraventricular nucleus stimulates feeding in rats: involvement of neuropeptide Y”. 《British Journal of Pharmacology》 164 (2b): 704–18. doi:10.1111/j.1476-5381.2011.01484.x. PMC 3188911. PMID 21564088.
- ↑ Gilad GM, Gilad VH (December 2013). “Evidence for oral agmatine sulfate safety--a 95-day high dosage pilot study with rats”. 《Food and Chemical Toxicology》 62: 758–62. doi:10.1016/j.fct.2013.10.005. PMID 24140462.
- ↑ Nissim I, Horyn O, Daikhin Y, Chen P, Li C, Wehrli SL, Nissim I, Yudkoff M (April 2014). “The molecular and metabolic influence of long term agmatine consumption”. 《The Journal of Biological Chemistry》 289 (14): 9710–29. doi:10.1074/jbc.M113.544726. PMC 3975019. PMID 24523404.
- ↑ Galgano F, Caruso M, Condelli N, Favati F (2012년 6월 7일). “Focused review: agmatine in fermented foods”. 《Frontiers in Microbiology》 3: 199. doi:10.3389/fmicb.2012.00199. PMC 3369198. PMID 22701114.
- ↑ Wang, Che-Chuan. "Beneficial Effect of Agmatine on Brain Apoptosis, Astrogliosis, and Edema after Rat Transient Cerebral Ischemia." BMC Pharmacology. BioMed Central, 6 Sept. 2010. Web. 03 Mar. 2016.
- ↑ Haenisch B, von Kügelgen I, Bönisch H, Göthert M, Sauerbruch T, Schepke M, Marklein G, Höfling K, Schröder D, Molderings GJ (November 2008). “Regulatory mechanisms underlying agmatine homeostasis in humans”. 《American Journal of Physiology. Gastrointestinal and Liver Physiology》 295 (5): G1104–10. doi:10.1152/ajpgi.90374.2008. PMID 18832451.
- ↑ Huisman H, Wynveen P, Nichkova M, Kellermann G (August 2010). “Novel ELISAs for screening of the biogenic amines GABA, glycine, beta-phenylethylamine, agmatine, and taurine using one derivatization procedure of whole urine samples”. 《Analytical Chemistry》 82 (15): 6526–33. doi:10.1021/ac100858u. PMID 20586417.
- ↑ Halaris A, Plietz J (2007). “Agmatine : metabolic pathway and spectrum of activity in brain”. 《CNS Drugs》 21 (11): 885–900. doi:10.2165/00023210-200721110-00002. PMID 17927294.
- ↑ Raasch W, Schäfer U, Chun J, Dominiak P (July 2001). “Biological significance of agmatine, an endogenous ligand at imidazoline binding sites”. 《British Journal of Pharmacology》 133 (6): 755–80. doi:10.1038/sj.bjp.0704153. PMC 1572857. PMID 11454649.
- ↑ Satriano J (July 2004). “Arginine pathways and the inflammatory response: interregulation of nitric oxide and polyamines: review article”. 《Amino Acids》 26 (4): 321–9. doi:10.1007/s00726-004-0078-4. PMID 15290337.
- ↑ Marc RE (April 1999). “Mapping glutamatergic drive in the vertebrate retina with a channel-permeant organic cation”. 《The Journal of Comparative Neurology》 407 (1): 47–64. doi:10.1002/(sici)1096-9861(19990428)407:1<47::aid-cne4>3.0.co;2-0. PMID 10213187.
- ↑ Su RB, Li J, Qin BY (July 2003). “A biphasic opioid function modulator: agmatine” (PDF). 《Acta Pharmacologica Sinica》 24 (7): 631–6. PMID 12852826. 2020년 11월 8일에 원본 문서 (PDF)에서 보존된 문서. 2020년 4월 22일에 확인함.
더 읽을거리
편집- Wilcox, G.; Fiska, A.; Haugan, F.; Svendsen, F.; Rygh, L.; Tjolsen, A.; Hole, K. (2004). “Central sensitization: The endogenous NMDA antagonist and NOS inhibitor agmatine inhibits spinal long term potentiation (LTP)”. 《The Journal of Pain》 5 (3): S19. doi:10.1016/j.jpain.2004.02.041.