이산화 황
무기 화합물
(아황산가스에서 넘어옴)
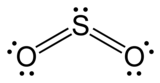
이산화 황(二酸化黃, sulfur dioxide)은 화학식 SO2인 무기 화합물이며, 아황산 가스, 무수 아황산이라고도 부른다. 산소 원자 2개와 황 원자 1개가 결합되어 있다. 색깔이 없으며 자극적인 냄새가 나는 유독성 기체이다. 화산 활동이나 유기 물질이 분해될 때 자연적으로 생긴다. 공업적으로는 황을 태우거나 황을 포함한 금속 화합물을 가열하여 만들며, 실험실에서는 아황산염에 산을 가하여 얻는다. 공장이나 발전소에서는 이산화 황이 대기중으로 들어오는데, 이때 공기중에 이산화 황이 기준치보다 높으면 눈에 염증이 생기거나 호흡기 질환이 일어난다. 또한 알레르기를 일으킬 수 있으며, 심하면 사망에 이르기도 한다. 직물의 표백제나 식품 방부제 등으로 쓰인다.

| |
| |
| |
| 이름 | |
|---|---|
| IUPAC 이름
Sulfur dioxide
| |
| 별칭
Sulfurous anhydride
Sulfur(IV) oxide | |
| 식별자 | |
3D 모델 (JSmol)
|
|
| 3535237 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.028.359 |
| EC 번호 |
|
| E 번호 | E220 (방부제) |
| 1443 | |
| KEGG | |
| MeSH | Sulfur+dioxide |
PubChem CID
|
|
| RTECS 번호 |
|
| UNII | |
| UN 번호 | 1079, 2037 |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| SO 2 | |
| 몰 질량 | 64.066 g mol−1 |
| 겉보기 | Colorless gas |
| 냄새 | Pungent; similar to a just-struck match[1] |
| 밀도 | 2.6288 kg m−3 |
| 녹는점 | −72 °C; −98 °F; 201 K |
| 끓는점 | −10 °C (14 °F; 263 K) |
| 94 g/L[2] forms sulfurous acid | |
| 증기 압력 | 237.2 kPa |
| 산성도 (pKa) | 1.81 |
| 염기도 (pKb) | 12.19 |
자화율 (χ)
|
−18.2·10−6 cm3/mol |
| 점도 | 12.82 μPa·s[3] |
| 구조 | |
| C2v | |
| Digonal | |
| Dihedral | |
| 1.62 D | |
| 열화학 | |
표준 몰 엔트로피 (S
|
248.223 J K−1 mol−1 |
표준 생성 엔탈피 (ΔfH⦵298)
|
−296.81 kJ mol−1 |
| 위험 | |
| GHS 그림문자 |  
|
| 신호어 | 위험 |
| H314, H331[4] | |
| NFPA 704 (파이어 다이아몬드) | |
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |
LC50 (median concentration)
|
3000 ppm (mouse, 30 min) 2520 ppm (rat, 1 hr)[6] |
LCLo (lowest published)
|
993 ppm (rat, 20 min) 611 ppm (rat, 5 hr) 764 ppm (mouse, 20 min) 1000 ppm (human, 10 min) 3000 ppm (human, 5 min)[6] |
| NIOSH (미국 건강 노출 한계): | |
PEL (허용)
|
TWA 5 ppm (13 mg/m3)[5] |
REL (권장)
|
TWA 2 ppm (5 mg/m3) ST 5 ppm (13 mg/m3)[5] |
IDLH (직접적 위험)
|
100 ppm[5] |
| 관련 화합물 | |
| Sulfur monoxide Sulfur trioxide | |
관련 화합물
|
Ozone |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
공해 손해배상소송
편집공장에서 배출된 오염물질(아황산가스)의 농도가 환경보전법에 의하여 허용된 기준치 이내라 하더라도 그 유해의 정도가 통상의 수인한도를 넘어 인근 농장의 관상수를 고사케하는 한 원인이 되었다면 그 배출행위로 인한 손해배상책임을 면치 못한다.[7]
각주
편집- ↑ Sulfur dioxide Archived 2019년 12월 30일 - 웨이백 머신, U.S. National Library of Medicine
- ↑ Lide, David R., 편집. (2006). 《CRC Handbook of Chemistry and Physics》 87판. Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ↑ Miller, J.W. Jr.; Shah, P.N.; Yaws, C.L. (1976). “Correlation constants for chemical compounds”. 《Chemical Engineering》 83 (25): 153–180. ISSN 0009-2460.
- ↑ https://echa.europa.eu/information-on-chemicals/cl-inventory-database/-/discli/notification-details/115657/1409763
- ↑ 가 나 다 NIOSH Pocket Guide to Chemical Hazards. “#0575”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ 가 나 “Sulfur dioxide”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 대법원 1991.7.23, 선고, 89다카1275, 판결
같이 보기
편집참고 자료
편집외부 링크
편집
| 이 글은 화학에 관한 토막글입니다. 여러분의 지식으로 알차게 문서를 완성해 갑시다. |
