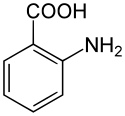
안트라닐산
안트라닐산(영어: anthranilic acid)은 화학식이 C6H4(NH2)(CO2H)인 방향족산이며 약간 달콤한 맛을 가지고 있다.[4][5][6] 2-아미노벤조산(영어: 2-aminobenzoic acid) 또는 o-아미노벤조산(영어: o-aminobenzoic acid), 줄여서 2-AA, 2AA, AA라고 지칭하기도 한다. 안트라닐산은 카복실산 및 아민으로 오쏘 치환된 벤젠 고리로 구성된다. 산성 작용기와 염기성 작용기를 모두 가지고 있기 때문에 안트라닐산은 양쪽성 물질이다. 순수한 안트라닐산은 흰색 고체이지만 상업적 샘플은 노란색을 보일 수 있다. 안트라닐산의 탈양성자화에 의해 얻어진 음이온 [C6H4(NH2)(CO2)]−을 안트라닐레이트(영어: anthranilate)라고 한다. 안트라닐산은 과거에 비타민으로 여겨졌었고, 그러한 맥락에서 비타민 L1으로 불렸었지만, 현재는 사람의 영양에 필수적이지 않은 것으로 알려져 있다.[7]
| |||
| 이름 | |||
|---|---|---|---|
| 우선명 (PIN)
2-aminobenzoic acid[1] | |||
| 체계명
2-Aminobenzenecarboxylic acid | |||
별칭
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| 3DMet | |||
| 471803 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.003.898 | ||
| EC 번호 |
| ||
| 3397 | |||
| KEGG | |||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C7H7NO2 | |||
| 몰 질량 | 137.138 g·mol−1 | ||
| 겉보기 | white or yellow solid | ||
| 냄새 | odorless | ||
| 밀도 | 1.412 g/cm3 | ||
| 녹는점 | 146 to 148 °C (295 to 298 °F; 419 to 421 K)[3] | ||
| 끓는점 | 200 °C (392 °F; 473 K) (sublimes) | ||
| 0.572 g/100 mL (25 °C) | |||
| 용해도 | very soluble in 클로로포름, 피리딘 soluble in 에탄올, 에터, 에틸 에터 slightly soluble in trifluoroacetic acid, 벤젠 | ||
| log P | 1.21 | ||
| 증기 압력 | 0.1 Pa (52.6 °C) | ||
| 산성도 (pKa) |
| ||
자화율 (χ)
|
-77.18·10−6 cm3/mol | ||
굴절률 (nD)
|
1.578 (144 °C) | ||
| 열화학 | |||
표준 생성 엔탈피 (ΔfH⦵298)
|
-380.4 KJ/mol | ||
| 위험 | |||
| 물질 안전 보건 자료 | External MSDS | ||
| GHS 그림문자 |  
| ||
| 신호어 | 위험 | ||
| H318, H319 | |||
| P264, P280, P305+351+338, P310, P337+313 | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | > 150 °C (302 °F; 423 K) | ||
| > 530 °C (986 °F; 803 K) | |||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LD50 (median dose)
|
1400 mg/kg (oral, rat) | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
구조
편집일반적으로 그렇게 언급되지는 않지만, 안트라닐산은 아미노산이다. 고체 상태의 안트라닐산은 아미노-카복실산 및 양쪽성 이온인 암모늄 카복실레이트의 형태로 구성된다.[8]
생성
편집안트라닐산을 생성하는 많은 경로가 설명되었다. 안트라닐산은 산업적으로 아민화에서 시작하여 무수 프탈산으로부터 생성된다.
- C6H4(CO)2O + NH3 + NaOH → C6H4(C(O)NH2)CO2Na + H2O
생성된 프탈아마이드산의 나트륨염은 차아염소산염에 의해 유도된 아마이드기의 호프만 자리옮김을 통해 탈카보닐화된다.[9]
- C6H4(C(O)NH2)CO2Na + HOCl → C6H4NH2CO2H + NaCl + CO2
이와 관련된 방법으로는 수용성 수산화 나트륨에서 하이포아브로민산 나트륨과 프탈이미드로 처리한 후 중화시키는 방법이 있다.[10] 인디고 염료를 식물로부터 얻던 시대에는 이를 분해하여 안트라닐산을 얻었다.
안트라닐산은 인디고 염료의 염기 유도 분해에 의해 최초로 얻어졌다.[11]
생합성
편집안트라닐산은 코리슴산으로부터 합성된다. 안트라닐산은 아미노기에 포스포리보실 피로인산의 부착을 통해서 아미노산인 트립토판의 전구체 역할을 한다.
용도
편집산업적으로 안트라닐산은 아조 염료 및 사카린의 생성에서 중간생성물이다. 안트라닐산 및 안트라닐산 에스터는 자스민과 오렌지를 모방한 향수, 의약품(푸로세미드와 같은 고리 이뇨제) 및 UV 흡수제 뿐만 아니라 금속에 대한 방청제 및 간장에서 살진균제를 제조하는데 사용된다.
안트라닐산 기반 방충제는 다이에틸톨루아마이드(DEET)의 대체제로서 제안되어 왔다.
페남산은 안트라닐산의 유도체이며,[12] 이는 아스피린의 활성 대사산물인 살리실산의 질소 등배전자체이다.[12] 메페남산, 톨페남산, 플루페남산, 메클로페남산을 포함한 몇몇 비스테로이드성 항염증제들은 페남산 또는 안트라닐산으로부터 유래되며, "안트라닐산 유도체" 또는 "페나메이트"로 불린다.[13]
반응
편집안트라닐산은 다이아조늄 양이온 [C6H4(CO2H)(N2)]+을 생성하기 위해 다이아조화 될 수있다. 다이아조늄 양이온은 벤자인을 생성하거나,[14] 이량체화되어 다이펜산을 생성하거나,[15] 또는 메틸 레드의 합성에서와 같은 다이아조늄 커플링 반응에 사용될 수 있다.[16]
안트라닐산은 포스젠과 반응하여 다용도 시약인 아이사토산 무수물을 생성한다.[17]
안트라닐산의 염소화는 2,4-다이클로로 유도체를 생성하며, 이는 환원 커플링을 거쳐 바이아릴 화합물을 형성할 수 있다.[18]
안전 및 규제
편집안트라닐산은 또한 현재 광범위하게 금지된 다행성 진정제인 메타콸론을 만드는 데 사용되기 때문에 미국 마약단속국(DEA) 화합물 목록 I의 화학물질이기도 하다.[19]
같이 보기
편집각주
편집- ↑ 〈Front Matter〉. 《Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)》. Cambridge: The Royal Society of Chemistry. 2014. 748쪽. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ↑ Haynes, William M., 편집. (2016). 《CRC Handbook of Chemistry and Physics》 97판. CRC Press. 5–89쪽. ISBN 978-1498754286.
- ↑ IPCS
- ↑ Acton, Q. Ashton (2013). 《Aminobenzoic Acids—Advances in Research and Application》 2013판. Atlanta: ScholarlyEditions. 23쪽. ISBN 9781481684842 – Google Books 경유.
- ↑ Hardy, Mark R. (1997). 〈Glycan Labeling with the Flurophores 2-Aminobenzamide and Antranilic Acid〉. Townsend, R. Reid; Hotchkiss, Jr., Arland T. 《Techniques in Glycobiology》. Marcel Dekker, Inc. 360쪽. ISBN 9780824798222 – Google Books 경유.
- ↑ The Merck Index, 10th Ed. (1983), p.62., Rahway: Merck & Co.
- ↑ Davidson, Michael W. (2004). “Anthranilic Acid (Vitamin L)]”. Florida State University. 2019년 11월 20일에 확인함.
- ↑ Brown, C. J. (1968). “The crystal structure of anthranilic acid”. 《Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences》 302 (1469): 185–199. Bibcode:1968RSPSA.302..185B. doi:10.1098/rspa.1968.0003.
- ↑ Maki, Takao; Takeda, Kazuo (2000). 〈Benzoic Acid and Derivatives〉. 《Ullmann's Encyclopedia of Industrial Chemistry》. doi:10.1002/14356007.a03_555. ISBN 3527306730..
- ↑ Vogel's Textbook of Practical Organic Chemistry, 4th Ed., (B. S. Furniss et al., Eds.) (1978), p.666, London: Longman.
- ↑ Sheibley, Fred E. (1943). “Carl Julius Fritzsche and the discovery of anthranilic acid, 1841”. 《Journal of Chemical Education》 20 (3): 115. Bibcode:1943JChEd..20..115S. doi:10.1021/ed020p115.
- ↑ 가 나 Sriram D, Yogeeswari P. Medicinal Chemistry, 2nd Edition. Pearson Education India, 2010. ISBN 9788131731444
- ↑ Auburn University course material. Jack DeRuiter, Principles of Drug Action 2, Fall 2002 1: Non-Steroidal Antiinflammatory Drugs (NSAIDS) Archived 2018년 9월 20일 - 웨이백 머신
- ↑ Logullo, F. M.; Seitz, A. H.; Friedman, L. (1968). “Benzenediazonium-2-carboxy- and Biphenylene”. 《Organic Syntheses》 48: 12.
- ↑ Atkinson, E. R.; Lawler, H. J. (1927). “Diphenic Acid”. 《Organic Syntheses》 7: 30. doi:10.15227/orgsyn.007.0030.
- ↑ Clarke, H. T.; Kirner, W. R. (1922). “Methyl Red”. 《Organic Syntheses》 2: 47.
- ↑ Wagner, E. C.; Fegley, Marion F. (1947). “Isatoic anhydride”. 《Org. Synth.》 27: 45. doi:10.15227/orgsyn.027.0045.
- ↑ Atkinson, Edward R.; Murphy, Donald M.; Lufkin, James E. (1951). “dl-4,4',6,6'-Tetrachlorodiphenic Acid”. 《Organic Syntheses》 31: 96.
- ↑ Angelos SA, Meyers JA (1985). “The isolation and identification of precursors and reaction products in the clandestine manufacture of methaqualone and mecloqualone”. 《Journal of Forensic Sciences》 30 (4): 1022–1047. PMID 3840834.