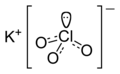
염소산 칼륨
염소산 칼륨(塩素酸kalium, potassium chlorate) 또는 염소산 포타슘은 KClO3 분자식을 지닌 화합물로, 칼륨, 염소, 산소 원자가 포함되어 있다. 순수 형태에서는 흰 결정 물질이다. 산업용으로 가장 흔한 염소산염이다. 광택이 있는 무색의 단사정계 결정이며 혼합폭약으로 쓰일 정도로 마찰과 충격에 예민해 잘 폭발한다. 더 가열하면 산소를 방출하고 전부 염화칼륨이 된다. 이 반응은 이산화망가니즈 MnO2와 같은 금속산화물을 가하면 촉진되어 70°C에서 산소를 발생하기 시작하므로, 실험실 등에서 산소를 얻기 위해 이용된다. 단, 유기물·황·탄소 등이 혼입되면 폭발하므로 주의해야 한다. 흡습성은 없다. 물에 녹고, 알코올에도 소량 녹는다. 중성 및 알칼리성 용액에서는 산화작용이 없으나, 산성 용액에서는 강한 산화제가 된다.
| |||

| |||
| 이름 | |||
|---|---|---|---|
| 별칭
Potassium chlorate(V), Potcrate
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.021.173 | ||
| EC 번호 |
| ||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | 1485 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| KClO3 | |||
| 몰 질량 | 122.55 g mol−1 | ||
| 겉보기 | white crystals or powder | ||
| 밀도 | 2.32 g/cm3 | ||
| 녹는점 | 356 °C (673 °F; 629 K) | ||
| 끓는점 | 400 °C (752 °F; 673 K) decomposes[1] | ||
| 3.13 g/100 mL (0 °C) 4.46 g/100 mL (10 °C) 8.15 g/100 mL (25 °C) 13.21 g/100 mL (40 °C) 53.51 g/100 mL (100 °C) 183 g/100 g (190 °C) 2930 g/100 g (330 °C)[2] | |||
| 용해도 | soluble in glycerol negligible in 아세톤 and liquid ammonia[1] | ||
| glycerol에서의 용해도 | 1 g/100 g (20 °C)[1] | ||
자화율 (χ)
|
−42.8·10−6 cm3/mol | ||
굴절률 (nD)
|
1.40835 | ||
| 구조 | |||
| monoclinic | |||
| 열화학 | |||
열용량 (C)
|
100.25 J/mol·K[1] | ||
표준 몰 엔트로피 (S
|
142.97 J/mol·K[3][1] | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
−391.2 kJ/mol[3][1] | ||
기브스 자유 에너지 (ΔfG˚)
|
-289.9 kJ/mol[1] | ||
| 위험 | |||
| 물질 안전 보건 자료 | ICSC 0548 | ||
| GHS 그림문자 |    [4] [4]
| ||
| 신호어 | 위험 | ||
| H271, H302, H332, H411[4] | |||
| P220, P273[4] | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LD50 (median dose)
|
1870 mg/kg (oral, rat)[5] | ||
| 관련 화합물 | |||
다른 음이온
|
Potassium bromate Potassium iodate Potassium nitrate | ||
다른 양이온
|
Ammonium chlorate Sodium chlorate Barium chlorate | ||
관련 화합물
|
Potassium chloride Potassium hypochlorite Potassium chlorite Potassium perchlorate | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||

| 화학식 | KClO3 |
|---|---|
| 분자량 | 122.55g/mol |
| 녹는점 | 368°C |
| 끓는점 | 400°C (분해) |
| 비중 | 2.326 (39°C) |
| 비열용량 | 100.25J/(mol·K) |
| 용해도 | 8.15g/100mL |
이용
편집다음의 용도로 쓰인다.
산화제로서 성냥·연화·폭약 등의 원료가 되고, 표백제·염료·의약품 등의 제조에도 사용된다. 장기간 보존한 것은 아염소산칼륨을 함유하여, 건조 상태에서는 유기물·인·황 등 가연성 물질과 접촉하기만 해도 폭발한다. 마찰·충격 등에 예민하여, 폭발사고를 잘 일으키며, 진한 황산이나 진한 질산과 접촉해도 잘 폭발한다. 혼합폭약으로 쓰이기도 하며, 극약이다. 빛이 차단되는 밀폐된 용기에 보관한다.
준비
편집- 3 NaOCl → 2NaCl + NaClO3
- KCl + NaClO3 → NaCl + KClO3
- 3Cl2(g) + 6KOH (aq) → KClO3 (aq) + 5KCl (aq) + 3H2O(l)
각주
편집- ↑ 가 나 다 라 마 바 사 “potassium chlorate”. 2015년 7월 9일에 확인함.
- ↑ Seidell, Atherton; Linke, William F. (1952). 《Solubilities of Inorganic and Organic Compounds》. Van Nostrand. 2014년 5월 29일에 확인함.
- ↑ 가 나 Zumdahl, Steven S. (2009). 《Chemical Principles 6th Ed.》. Houghton Mifflin Company. A22쪽. ISBN 0-618-94690-X.
- ↑ 가 나 다 “Potassium chlorate”. 2012년 9월 22일에 원본 문서에서 보존된 문서. 2015년 7월 9일에 확인함.
- ↑ Michael Chambers. “ChemIDplus - 3811-04-9 - VKJKEPKFPUWCAS-UHFFFAOYSA-M - Potassium chlorate - Similar structures search, synonyms, formulas, resource links, and other chemical information.”. 2015년 7월 9일에 확인함.
- ↑ Manochai, P.; Sruamsiri, P.; Wiriya-alongkorn, W.; Naphrom, D.; Hegele, M.; Bangerth, F. (2005년 2월 12일). “Year around off season flower induction in longan (Dimocarpus longan, Lour.) trees by KClO3 applications: potentials and problems”. 《Scientia Horticulturae》 (Department of Horticulture, Maejo University, Chiang Mai, Thailand; Department of Horticulture, Chiang Mai University, Chiang Mai, Thailand; Institute of Special Crops and Crop Physiology, University of Hohenheim, 70593 Stuttgart, Germany) 104 (4): 379–390. 2010년 11월 28일에 확인함.
외부 링크
편집- 위키미디어 공용에 염소산 칼륨 관련 미디어 분류가 있습니다.
같이 보기
편집| 이 글은 화학에 관한 토막글입니다. 여러분의 지식으로 알차게 문서를 완성해 갑시다. |