염화 알루미늄
화합물
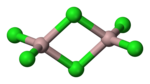
염화 알루미늄(Aluminium chloride, AlCl3) 또는 알루미늄 삼염화물(aluminium trichloride)은 화학식 AlCl3(H2O)n (n = 0 or 6)을 지니는 화합물을 가리킨다. 비율이 1:3인 알루미늄과 염소 원자로 구성된다. 둘 다 흰 고체이지만 샘플은 종종 염화철(III)과 오염되는 경우가 있어 노란색을 띈다.

| |
| |
| 이름 | |
|---|---|
| IUPAC 이름
aluminium chloride
| |
| 별칭
aluminium(III) chloride
aluminum trichloride | |
| 식별자 | |
| |
3D 모델 (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.371 |
| EC 번호 |
|
| 1876 | |
PubChem CID
|
|
| RTECS 번호 |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| 성질 | |
| AlCl3 | |
| 몰 질량 | 133.341 g/mol (anhydrous) 241.432 g/mol (hexahydrate)[1] |
| 겉보기 | white or pale yellow solid, 흡습성 |
| 밀도 | 2.48 g/cm3 (anhydrous) 2.398 g/cm3 (hexahydrate)[1] |
| 녹는점 | 192.6 °C (378.7 °F; 465.8 K) (anhydrous)[1] 100 °C (212 °F; 373 K) (hexahydrate, dec.)[1] |
| 끓는점 | 180 °C (356 °F; 453 K) (sublimes)[1] |
| 439 g/l (0 °C) 449 g/l (10 °C) 458 g/l (20 °C) 466 g/l (30 °C) 473 g/l (40 °C) 481 g/l (60 °C) 486 g/l (80 °C) 490 g/l (100 °C) | |
| 용해도 | soluble in hydrogen chloride, ethanol, chloroform, carbon tetrachloride slightly soluble in benzene |
| 증기 압력 | 133.3 Pa (99 °C) 13.3 kPa (151 °C)[2] |
| 점도 | 0.35 cP (197 °C) 0.26 cP (237 °C)[2] |
| 구조 | |
| 단사정계, mS16 | |
| C12/m1, No. 12[3] | |
a = 0.591 nm, b = 0.591 nm, c = 1.752 nm[3]
| |
단위 세포 부피 (V)
|
0.52996 nm3 |
단위 세포 화학식 (Z)
|
6 |
| Octahedral (solid) Tetrahedral (liquid) | |
| Trigonal planar (단량체ic vapour) | |
| 열화학 | |
열용량 (C)
|
91.1 J/mol·K[4] |
표준 몰 엔트로피 (S
|
109.3 J/mol·K[4] |
표준 생성 엔탈피 (ΔfH⦵298)
|
−704.2 kJ/mol[4] |
기브스 자유 에너지 (ΔfG˚)
|
-628.8 kJ/mol[4] |
| 약리학 | |
| D10AX01 (WHO) | |
| 위험 | |
| GHS 그림문자 |  [5] [5]
|
| 신호어 | 위험 |
| H314[5] | |
| P280, P310, P305+351+338[5] | |
| NFPA 704 (파이어 다이아몬드) | |
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |
LD50 (median dose)
|
anhydrous: 380 mg/kg, rat (oral) hexahydrate: 3311 mg/kg, rat (oral) |
| NIOSH (미국 건강 노출 한계): | |
PEL (허용)
|
none[6] |
REL (권장)
|
2 mg/m3[6] |
IDLH (직접적 위험)
|
N.D.[6] |
| 관련 화합물 | |
다른 음이온
|
en:Aluminium fluoride en:Aluminium bromide en:Aluminium iodide |
다른 양이온
|
en:Boron trichloride en:Gallium trichloride en:Indium(III) chloride en:Magnesium chloride |
| en:Iron(III) chloride en:Boron trifluoride | |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
무수물은 상업적으로 중요하다. 녹는점/끓는점이 낮다. 알루미늄 금속 생산에 주로 생산/소비되지만 화학 산업의 다른 분야에서 대량으로 사용되기도 한다.[7] 이 화합물은 루이스산으로 인용되기도 한다. 이는 온화한 온도에서 중합체에서 단량체로 거꾸로 되돌리는 무기 화합물의 한 예이다.
안전
편집무수물 AlCl3는 염기와 격렬하게 반응하므로 적절한 주의가 필요하다. 흡입하거나 접촉하는 경우 안구, 피부, 호흡계에 자극을 줄 수 있다.[8]
각주
편집- ↑ 가 나 다 라 마 Haynes, William M., 편집. (2011). 《CRC Handbook of Chemistry and Physics》 92판. Boca Raton, FL: CRC Press. 4.45쪽. ISBN 1439855110.
- ↑ 가 나 Aluminum chloride 보관됨 2014-05-05 - 웨이백 머신. Chemister.ru (2007-03-19). Retrieved on 2017-03-17.
- ↑ 가 나 Ketelaar, J. A. A. (1935). “Die Kristallstruktur der Aluminiumhalogenide II”. 《Zeitschrift für Kristallographie – Crystalline Materials》 90 (1–6). doi:10.1524/zkri.1935.90.1.237. S2CID 100796636.
- ↑ 가 나 다 라 Haynes, William M., 편집. (2011). 《CRC Handbook of Chemistry and Physics》 92판. Boca Raton, FL: CRC Press. 5.5쪽. ISBN 1439855110.
- ↑ 가 나 다 Sigma-Aldrich Co. Retrieved on 2014-05-05.
- ↑ 가 나 다 NIOSH Pocket Guide to Chemical Hazards. “#0024”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ Helmboldt, Otto; Keith Hudson, L.; Misra, Chanakya; Wefers, Karl; Heck, Wolfgang; Stark, Hans; Danner, Max; Rösch, Norbert (2007), 〈Aluminum Compounds, Inorganic〉, 《울만 공업화학 백과사전(Ullmann's Encyclopedia of Industrial Chemistry)》, Weinheim: Wiley-VCH, doi:10.1002/14356007.a01_527.pub2
- ↑ Aluminum Chloride. solvaychemicals.us
