인디나비르
이 문서는 자연스럽지 않게 번역되었으며, 기계 번역을 통해 작성되었을 수도 있습니다. (2021년 6월) |
인디나비르(IDV; 머크가 만든 상품명 Crixiban)는 HIV/AIDS 치료(HAAT)를 위한 항레트로바이러스제로 사용되는 단백질 분해효소 억제제이다. 다른 항바이러스제와 함께 구강으로 투여하고 가용성 백색 가루 형태를 가지고 있다. 효과는 프로테아제가 정상적으로 작동하지 못하게 하는 것이다. 그로 인해 HIV는 번식할 수 없고, 바이러스 수의 감소를 끌어낸다. 현재 상업적으로 판매되는 인디나비르는 무수 인디나비르인데, 인디나비르의 hydroxy ethylene에 아민이 추가된 구조이다. 이러한 잔기를 추가함으로써 용해성과 경구 생체이용률을 높여 사용자가 쉽게 섭취할 수 있도록 해준다.[1]
| |

| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
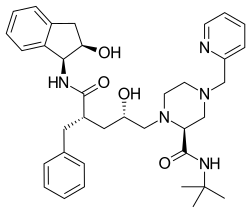
| (2S)-1-[(2S,4R)-4-benzyl-2-hydroxy-4-{[(1S,2R)-2-hydroxy-2,3-dihydro-1H-inden-1-yl]carbamoyl}butyl]-N-tert-butyl-4-(pyridin-3-ylmethyl)piperazine-2-carboxamide | |
| 식별 정보 | |
| CAS 등록번호 | 150378-17-9 |
| ATC 코드 | J05AE02 |
| PubChem | 5362440 |
| 드러그뱅크 | DB00224 |
| ChemSpider | 4515036 |
| 화학적 성질 | |
| 화학식 | C36H47N5O4 |
| 분자량 | ? |
| SMILES | eMolecules & PubChem |
| 약동학 정보 | |
| 생체적합성 | ~65% |
| 단백질 결합 | 60% |
| 동등생물의약품 | ? |
| 약물 대사 | Hepatic via CYP3A4 |
| 생물학적 반감기 | 1.8 ± 0.4 hours |
| 배출 | ? |
| 처방 주의사항 | |
| 허가 정보 | |
| 임부투여안전성 | C(미국) |
| 법적 상태 | |
| 투여 방법 | Oral |
현재는 부작용 때문에 HIV/AIDS 치료에 사용하지 않는 편이다. 더욱이 개발부터 사용법까지 여러 가지 이유로 논란이 있다.
1991년 특허를 받았고 1996년 의료용 허가를 받았다.[2]
의학적 사용
편집인디나비르는 에이즈(HIV/AIDS)를 치료하지는 않지만, 병의 진행을 늦춤으로써 사람의 수명을 연장할 수 있다. 머크에서 만들어지는 널리 사용되고 있는 타입은 인디나비르 황산염이다. 이 알약은 황산염으로 만들어지며 100mg, 200mg, 333mg, 400mg 용량으로 판매된다. 보통 HIV에 대한 삼중결합 요법에서 세 가지 약 중 하나로 사용된다.[1]
시중에서 구할 수 있는 캡슐은 15 - 30 °C에 보관해야 한다. 그리고 수분기가 닿지 않도록 용기에 보관해야 하며 제조사가 제공한 병에 약을 보관하며 건조제를 제거하지 않는 것이 좋다.[1]
인디나비르는 투약 후 금방 분해된다. 인디나비르는 HIV가 다른 단백질분해효소 억제제에 대한 저항을 포함하여 약물에 내성이 있는 돌연변이를 형성하는 것을 막기 위해 8시간마다 400mg의 매우 정밀한 투여를 해야 한다. 모두 식후 1~2시간 후 충분한 물과 함께 약을 먹어야 한다. 추가로 환자가 인디나비르를 복용할 때 하루에 최소 1.5L를 마시는 것이 좋다. 환자가 복용한 인디나비르의 낮은 용해성으로 인해 결정화될 수 있기 때문이다. 또한 특정 종류의 음식을 먹는 것에 대한 제약이 있다. 이러한 단점(복용에 대한 부담과 신장결석의 위험성) 때문에 미국에서는 더 초기 치료에 사용하지 않는 것으로 추천하고 있다.[4]
바이러스 저항성
편집많은 사람들은 AZT(지도부딘) 등 일어난 이전의 사건들 때문에 인디나비르가 큰 효과를 가질것이라는 생각에 회의적이다. 바이러스가 약물의 효과인 프로테아제 억제제에 저항할 수 있는 능력을 가지도록 진화하기 때문에 약물의 효과는 감소한다. 이를 최대한 피하려면 환자가 할당된 시간에 정확한 양의 약을 꾸준히 복용하는 것이 중요하다. 이러한 바이러스 저항성에 대한 이러한 두려움 때문에 많은 환자들이 이 약의 복용을 걱정한다.[5]
부작용
편집인디나비르의 가장 일반적인 부작용은 다음과 같다.
화학적인 특성
편집인디나비르는 하얀 결정 가루상태이다. 물과 메탄올에 매우 쉽게 용해되며 각각의 캡슐에는 무수 유당(anhydrous lactose)과 마그네슘 스테아르산염 (magnesium stearate)외에 황산염이 들어있다. 캡슐 껍질은 젤라틴(gelatin)과 이산화티타늄(titanium dioxide)으로 만들어져있다. 녹는점 또는 분해온도는 150 - 153 °C이며, 이때 질소산화물과 황산화물과 같은 유독성 증기를 방출한다.[12]
인디나비르는 프로테아제와 상호작용으로 정상적으로 작동하지 못하게 한다. 그 결과, HIV에 필요한 gag 나 gag-pol유전자(레트로바이러스가 가지는 유전자)의 폴리펩타이드에서 비롯된 단백질의 구조를 제대로 형성될 수 없다. 결국 바이러스 수는 단백질의 재생산이 부족하기 때문에 감소하게 된다.[13]
역사
편집개발의 공식적인 시작은 1986년 12월 머크의 Edward Scolnick 사장이 종합적인 에이즈 연구 프로그램을 시작하겠다고 발표하면서 시작되었다. 이 회사는 펜실베이니아 웨스트 포인트에서 Emilio Emini를 연구소의 책임자로 임명하고 에이즈 연구를 전담하는 연구소를 발족했다.[14] 몇 달 후인 1987년 1월 Emilio Emini, Joel Huff, Irving Sigal로 구성된 연구팀이 프로테아제 효소와 레닌에 대한 초기 연구를 바탕으로 연구를 시작했다.[15] 연구원들은 단백질분해효소 억제제 및 바이러스와 관련된 연구 개발 과정을 겪어본 사람들이기에 그로부터 1년여가 지난 1988년 7월 Nancy Kohl, Emilio Emini 외 연구진이 단백질분해효소를 억제하는 아이디어에 대해 국립과학원회보(Procedition of the National Academy of Science)에 발표했다.[14]1989년 2월 Manuela Navia, Paula Fitzgerald 외 연구진은 HIV의 단백질분해효소의 3차원 구조를 보여주는 논문을 발표했다.[15] 다른 연구자들은 이 연구가 억제제 개발의 향후 궤적을 결정하는 데 도움이 되었다고 설명했다. 많은 연구 끝에 1990년 3월 라이더 휘하의 연구자들은 L-689, 502 화합물의 일부를 합성하는 특허를 받았다. 이것들은 기존의 억제제와 유사 했지만 강한 독성 때문에 안전 평가에 실패했다.[14] 머크는 그러한 약에 대한 연구를 통해 시판 가능성을 보고 1991년 3월에 약개발에 도움을 줄 에이즈 활동가들로 구성된 지역사회 자문 위원회를 설립하기로 결정했다.[14] 1992년 1월 연구자들은 인디나비르 황산염(indinavir sulfate, Crixivan)을 합성했는데, compound number L-735,524가 할당되었다. 연구자들은 몇 달 후 L-735,524를 동물들에게 실험하기 시작했고 이 화합물이 동물들에게 안전하다는 것을 발견했다. 이에 따라 머크는 같은 해 9월 임상시험을 시작하는 것이 안전하다고 판단했다.[14] 미국 식품의약국(FDA)은 1996년 3월 인디나비르를 승인하여 여덟 번째 항레트로바이러스제가 되었다. 이는 회사가 FDA에 약물을 제출한 지 42일 만인 3월 1일 FDA에 의해 처음으로 승인되었다. 이러한 빠른 승인의 주요 사유는 머크 Study 035(아래 참조)의 결과와 함께 위원회에 제출한 프레젠테이션이었다. 하지만 HIV/AIDS에 감염된 사람들에게 약물사용의 가속화가 이롭지 않다고 생각하는 트리트먼트 액션 그룹(Treatment Action Group)과 같은 단체들은 인디나비르가 빠른 승인을 받았다는 사실을 문제로 삼았다.[15]
이때부터 이중 NRTIs(역전사효소 억제제)와 함께 사용되는 인디나비르는 HIV/AIDS 치료의 새로운 기준을 세웠다. 단백질분해효소 억제제는 에이즈의 성격을 심각한 말기 질환에서 다소 관리가 가능한 질환으로 바꾸었다. 그것은 바이러스로부터 면역체계가 약해진 결과인 감염병으로 인한 낮아진 기대수명을 크게 증가시키고 눈에 띄는 증상들을 감소시켰다. 그래도 지금은 복용하기 편리하고, 바이러스 내성을 촉진할 가능성이 적으며, 다루나비르나 아타자나비르와 같은 독성이 적은 신약으로 대체되고 있다.[15]
임상시험
편집1996년 1월, 머크는 인디나비르가 임상적으로 효율적인 약물이라는 것을 임상시험의 데이터를 바탕으로 증명했다. 인디나비르가 두 개의 다른 항-HIV 약물과 함께 사용될 때 HIV 바이러스 수를 현저하게 줄일 수 있다는 것을 보여줄 수 있었다.[16]
Study 035
편집이 연구의 목표는 다른 항바이러스 치료의 다른 효과를 보여주는 것이었다. 97명의 환자를 인디나비르, AZT, 라미부딘 등 3개 그룹 중 하나에 무작위로 배정하거나 3가지를 모두 받는 그룹으로 나누었다. 시험에 지원하는 환자들은 AZT를 6개월 이상 복용하고 CD4 세포수가 50~400개 사이, 바이러스 수가 최소 20만copies/mL이며 프로테아제 억제제나 라미부딘을 사용하기 이전에 다른 항레트로바이러스 요법을 받지 않았어야 했다.[17]연구 결과는 가장 효과적인 치료법은 세 가지 모두 받는 약물 치료로 나타났다. 24주간의 치료 후, 3가지 약물로 치료받은 28명의 환자 중 24명의 환자는 바이러스 부하 수준이 500copies/ml 미만이었다. 인디나비르 하나만 처방받은 28명 중 12명이 500부/ml에 도달했고, AZT와 라미부딘 그룹의 30명 환자 중 한 명도 500copies/ml 이하가 되지 않았다.[17]
ACTG 320
편집이 연구는 다양한 치료법의 임상적 효율성에 대해 살펴보는 것이다. 시험에 참가한 환자들은 실험 전에 CD4 세포수가 200개 미만이고 적어도 3개월의 AZT 치료를 받아야 했다. 평균 CD4 세포수가 87개, 평균 바이러스 수가10만 copies/ml인 1156명의 환자들은 두 그룹 중 하나로 무작위로 배정받았다. 2약 그룹: AZT+라미부딘 3약 그룹: 리미부딘 +인디나비르+AZT
Study 035와 마찬가지로, 참가 환자는 사전에 프로테아제 억제제 치료나 라미부딘 처방이 1주일 이상 있으면 연구에 참여할 수 없었다.[18]
8주 후, 3약 그룹 인구의 6%가 사망했고, 2약 그룹에서는 11%가 사망하였다. 3약 그룹에 배정된 환자들에서는 CD4 세포수가 더 높았고 바이러스 수는 더 적었으며, 3약 치료가 2약보다 더 효율적이라는 것을 증명했다.[18]
논란
편집공급
편집머크는 감염된 모든 사람들에게 나눠줄 충분한 약을 준비할 충분한 시간이 없었다. 65만~90만 명이 바이러스에 감염됐고, 머크는 약 2만5000~3만 명에게만 약을 제공할 수 있었다. 게다가, 약물을 지속적으로 복용해야 하기에 복용환자들이 위험에 직면할 수도 있다. 즉, 회사는 약을 복용하는 사용자를 위한 재생산을 고려해야 했기에 공급이 제한된 이런 상황은 많은 활동가들이 이렇게 한정된 수량으로 판매하고 있다는 사실에 분노하게 만들었다.[19]
분배
편집머크는 공급량이 제한되어 있기 때문에 인디나비르를 한 제약 소매업체에만 보내는 단일 유통사 시스템을 채택하기로 결정했다. Stadtalnder's Pharmacy에 유통했고 , 한정된 수량은 미국 보훈부의 병원과 일부 관리 기관에 유통했다. 이것러한 유통은 약의 가격을 올리게 했고, 약에 접근할 수 있는 사람들의 수를 제한했다.[20]
가격
편집인디나비르는 1일 투약 시 약 12달러가 들어 인비라세(Invirase)보다 24%, 노르비르(Norvir)보다 33% 저렴하다.[19] 하지만 머크는 약을 연구하고 개발하는데 많은 비용이 들었고, 정상적인 유통 시스템을 통해 이 약을 팔 수 있는 충분한 물자가 없다고 주장하며 머크는 단일 유통업체 시스템을 이용해 약품을 담당하는 약국이 소매가를 37% 인상했다. 그렇기에 활동가들은 이러한 가격 인상이 사람들이 그 약에 접근하는 것을 더 어렵게 만들었기에 항의했다.[20]
각주
편집- ↑ 가 나 다 Pubchem. “Indinavir”. 《pubchem.ncbi.nlm.nih.gov》 (영어). 2018년 10월 22일에 확인함.
- ↑ Fischer, Jnos; Ganellin, C. Robin (2006). 《Analogue-based Drug Discovery》 (영어). John Wiley & Sons. 509쪽. ISBN 9783527607495.
- ↑ Liu F, Boross PI, Wang YF, Tozser J, Louis JM, Harrison RW, Weber IT (December 2005). “Kinetic, stability, and structural changes in high-resolution crystal structures of HIV-1 protease with drug-resistant mutations L24I, I50V, and G73S”. 《Journal of Molecular Biology》 354 (4): 789–800. doi:10.1016/j.jmb.2005.09.095. PMC 1403828. PMID 16277992.
- ↑ “Crixivan (Indinavir Sulfate): Side Effects, Interactions, Warning, Dosage & Uses”. 《RxList》 (영어). 2018년 11월 8일에 확인함.
- ↑ Cohen J (June 1996). “Protease inhibitors: a tale of two companies”. 《Science》 272 (5270): 1882–3. Bibcode:1996Sci...272.1882C. doi:10.1126/science.272.5270.1882. PMID 8658156. S2CID 84869965.
- ↑ 가 나 “Crixivan (Indinavir Sulfate): Side Effects, Interactions, Warning, Dosage & Uses”. 《RxList》 (영어). 2018년 11월 8일에 확인함.
- ↑ Capaldini L (August 1997). “Protease inhibitors' metabolic side effects: cholesterol, triglycerides, blood sugar, and "Crix belly." Interview with Lisa Capaldini, M.D. Interview by John S. James”. 《AIDS Treatment News》 (277): 1–4. PMID 11364559.
- ↑ “Indinavir”. 《livertox.nih.gov》. 2018년 10월 21일에 확인함.
- ↑ MacGill, Markus (2018년 7월 24일). “High bilirubin levels: Meaning, symptoms, and tests”. 《Medical News Today》. 2018년 10월 21일에 확인함.
- ↑ Eira M, Araujo M, Seguro AC (August 2006). “Urinary NO3 excretion and renal failure in indinavir-treated patients”. 《Brazilian Journal of Medical and Biological Research》 39 (8): 1065–70. doi:10.1590/s0100-879x2006000800009. PMID 16906281.
- ↑ Shankar SS, Dubé MP, Gorski JC, Klaunig JE, Steinberg HO (November 2005). “Indinavir impairs endothelial function in healthy HIV-negative men”. 《American Heart Journal》 150 (5): 933.e1–933.e7. doi:10.1016/j.ahj.2005.06.005. PMID 16290967.
- ↑ “Crixivan (Indinavir Sulfate): Side Effects, Interactions, Warning, Dosage & Uses”. 《RxList》 (영어). 2018년 11월 8일에 확인함.
- ↑ Pubchem. “Indinavir”. 《pubchem.ncbi.nlm.nih.gov》 (영어). 2018년 10월 22일에 확인함.
- ↑ 가 나 다 라 마 “History and the Discovery and Development of Crixivan”. 《quod.lib.umich.edu》. 2018년 10월 24일에 확인함.
- ↑ 가 나 다 라 Cohen J (June 1996). “Protease inhibitors: a tale of two companies”. 《Science》 272 (5270): 1882–3. Bibcode:1996Sci...272.1882C. doi:10.1126/science.272.5270.1882. PMID 8658156. S2CID 84869965.
- ↑ Cohen J (June 1996). “Protease inhibitors: a tale of two companies”. 《Science》 272 (5270): 1882–3. Bibcode:1996Sci...272.1882C. doi:10.1126/science.272.5270.1882. PMID 8658156. S2CID 84869965.
- ↑ 가 나 Gulick RM, Mellors JW, Havlir D, Eron JJ, Gonzalez C, McMahon D, 외. (September 1997). “Treatment with indinavir, zidovudine, and lamivudine in adults with human immunodeficiency virus infection and prior antiretroviral therapy”. 《The New England Journal of Medicine》 337 (11): 734–9. doi:10.1056/nejm199709113371102. PMID 9287228.
- ↑ 가 나 Hammer SM, Squires KE, Hughes MD, Grimes JM, Demeter LM, Currier JS, 외. (September 1997). “A controlled trial of two nucleoside analogues plus indinavir in persons with human immunodeficiency virus infection and CD4 cell counts of 200 per cubic millimeter or less. AIDS Clinical Trials Group 320 Study Team”. 《The New England Journal of Medicine》 337 (11): 725–33. doi:10.1056/nejm199709113371101. PMID 9287227.
- ↑ 가 나 Tanouye, Elyse; Waldholz, Michael. “Merck Attracts Controversy With Marketing of AIDS Drug”. 《Wall Street Journal》 (미국 영어). 2018년 11월 8일에 확인함.
- ↑ 가 나 Hilts, Philip J. “With Record Speed, F.D.A. Approves a New AIDS Drug” (영어). 2018년 10월 24일에 확인함.