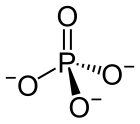
인산염
인산염(燐酸鹽, 영어: phosphate)은 화학에서 인산으로부터 유도된 음이온, 염, 작용기 또는 에스터이다. 인산염은 일반적으로 오르토인산(H
3PO
4)의 유도체인 오르토인산염(영어: orthophosphate)을 의미한다.
| |||
| |||
| 이름 | |||
|---|---|---|---|
| 체계명
phosphate[1] | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| 3903772 | |||
| ChEBI | |||
| ChemSpider | |||
| 1997 | |||
| MeSH | Phosphates | ||
PubChem CID
|
|||
| UNII | |||
| |||
| |||
| 성질 | |||
| PO3− 4 | |||
| 몰 질량 | 94.9714 g mol−1 | ||
| 짝산 | 인산 일수소 | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
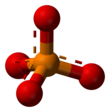
인산염 또는 오르토인산염 이온 [PO
4]3−
은 인산으로부터 3개의 양성자(H+
)가 제거되어 형성된다. 인산에서 1개의 양성자가 제거되면 인산 이수소 이온 [H
2PO
4]−
이, 2개의 양성자가 제거되면 인산 수소 이온 [HPO
4]2−
이 각각 생성된다. 이러한 명칭은 인산 이수소 암모늄 및 인산 삼나트륨과 같은 이들 음이온의 염에도 사용된다.
-
H
3PO
4
인산 -
[H
2PO
4]−
인산 이수소 -
[HPO
4]2−
인산 수소 -
[PO
4]3−
인산염
유기화학에서 인산염 또는 오르토인산염은 하나 이상의 수소 원자가 유기기로 치환된 PO
4RR′R″ 형태의 오르토인산의 에스터인 유기인산염이다. 예로는 인산 트라이메틸 (CH
3)
3PO
4이 있다. 이 용어는 또한 이들 에스터에서 3가 작용기 OP(O-)
3를 지칭한다.
오르토인산염은 생화학, 생물지구화학 및 생태학에서의 중요한 역할과 농업 및 산업에 대한 경제적 중요성 때문에 다양한 인산염들 중에서 특히 중요하다.[2] 인산기의 첨가 및 제거(인산화 및 탈인산화)는 세포의 물질대사에서 핵심적인 단계이다.
화학적 특성
편집인산염 이온은 94.97 g/mol의 몰 질량을 가지며, 사면체 배열의 4개의 산소 원자로 둘러싸인 구조의 중심에 인 원자로 구성된다. 인산염 이온은 인산 수소 이온 H(PO
4)2−
의 짝염기이며, 인산 수소 이온은 인산 이수소 이온 H
2(PO
4)−
의 짝염기이며, 인산 이수소 이온은 오르토인산 H
3PO
4의 짝염기이다.
많은 인산염들은 표준 온도와 압력에서 물에 용해된다. 인산 나트륨, 인산 칼륨, 인산 루비듐, 인산 세슘, 인산 암모늄은 모두 수용성이다. 대부분의 다른 인산염들은 물에 약간만 용해되거나 불용성이다. 일반적으로 인산 수소 및 인산 이수소는 해당하는 인산염보다 약간 더 용해된다.
용액에서의 평형
편집수용액에서 오르토인산과 파생되는 3가지 음이온은 다음의 해리 및 재결합의 평형에 따라 공존한다.[3]
| 평형 | 해리 상수 Ka[4] | pKa |
|---|---|---|
| H3PO4 H 2PO− 4 + H+ |
Ka1 = [ H+ ] [ H 2PO− 4 ] / [ H 3PO 4 ] ≈ 7.5 × 10−3 |
pKa1 = 2.14 |
| H 2PO− 4 HPO2− 4 + H+ |
Ka2 = [ H+ ] [ HPO2− 4 ] / [ H 2PO− 4 ] ≈ 6.2 × 10−8 |
pKa2 = 7.20 |
| HPO2− 4 PO3− 4 + H+ |
Ka3 = [ H+ ] [ PO3− 4 ] / [ HPO2− 4 ] ≈ 2.14 × 10−13 |
pKa3 = 12.37 |
수치는 25 ℃에서의 0의 이온 강도이다.
pKa 값은 각 화학종의 농도가 짝염기의 농도와 동일한 pH 값이다. pH 1 이하에서는 인산이 거의 해리되지 않는다. pH 4.7 부근(처음 두 pKa 값 사이의 중간값)에서 인산 이수소 이온인 [H
2PO
4]−
가 실제로 존재하는 유일한 화학종이다. pH 9.8 부근(두 번째와 세 번째 pKa 값의 중간값)에서 인산일수소 이온인 [HPO
4]2−
가 실제로 존재하는 유일한 화학종이다. pH 13 이상에서 인산은 인산 이온 (PO
4)3−
으로 완전히 해리된다.
이것은 pH 값을 4.7 또는 9.8로 설정함으로써 일인산 이온 및 이인산 이온의 염이 수용액에서 선택적으로 결정화될 수 있음을 의미한다.
실제로 H
3PO
4, H
2(PO
4)−
, H(PO
4)2−
는 연속적인 pKa가 4 이상 차이가 나기 때문에 별도의 약산으로 작용한다.
인산염은 피로인산염 (P
2O
7)4−
및 삼인산염 (P
3O
10)5−
과 같은 많은 고분자 이온을 형성할 수 있다. 다양한 메타인산염 이온(보통 긴 선형 중합체임)은 (PO
3)−
의 실험식을 가지며 많은 화합물에서 발견된다.
인산염의 생화학
편집생물학적 시스템에서 인은 용액(무기 인산염)에서 유리 인산염 음이온으로 발견되거나 다양한 유기인산염으로 유기 분자에 결합할 수 있다.
무기 인산염은 일반적으로 "Pi"로 표시되며 생리학적 pH에서 주로 [HPO
4]2−
및 [H
2PO
4]−
이온의 혼합물로 구성된다. 중성 pH에서 세포질(pH = 7.0)에서와 같이 오르토인산과 이의 3가지 음이온의 농도는 다음과 같은 비율을 갖는다.
- [ H
2PO−
4 ] / [ H
3PO
4 ] ≈ 7.5 × 104 - [ HPO2−
4 ] / [ H
2PO−
4 ] ≈ 0.62 - [ PO3−
4 ] / [ HPO2−
4 ] ≈ 2.14 × 10−6
따라서 [H
2PO
4]−
및 [HPO
4]2−
이온 만이 세포질에 상당한 양으로 존재([H
2PO
4]−
: 62%, [HPO
4]2−
: 38%)한다. 세포외액(pH = 7.4)에서 이 비율은 반대([HPO
4]2−
: 61%, [H
2PO
4]−
: 39%)이다.
무기 인산염은 다음과 같이 가수분해에 의해 오르토인산염을 생성할 수 있는 피로인산염 음이온 [P
2O
7]4−
으로도 존재할 수 있다
- [P
2O
7]4−
+ H2O 2 [HPO
4]2−
유기인산염은 일반적으로 뉴클레오타이드(예: AMP, ADP, ATP 등)로서의 에스터 형태와 DNA, RNA에서 발견된다. 유리 오르토인산염 음이온은 ATP 또는 ADP에 있는 고에너지 인산 결합의 가수분해에 의해 방출될 수 있다. 이러한 인산화 및 탈인산화 반응은 많은 대사 과정에서 즉각적인 에너지 저장 및 에너지 공급원이다. ATP와 ADP는 종종 근육 조직의 포스파젠과 마찬가지로 고에너지 인산으로 불린다. 다른 뉴클레오사이드 이인산 및 뉴클레오사이드 삼인산에 대해서도 유사한 반응이 존재한다.
뼈와 치아
편집생물학적 시스템에서 인산염의 중요한 역할은 뼈와 치아를 구성하는 구조적 물질로 사용되는 것이다. 이러한 구조는 수산화인회석 형태의 결정질 인산 칼슘으로 만들어진다. 포유동물 치아의 단단하고 조밀한 에나멜은 플루오린인회석, 즉 하이드록실기의 일부가 플루오린화물 이온으로 치환된 수산화인산 칼슘으로 구성되어 있다.
의학 및 생물학 연구 용도
편집인의 의약 유형(염)은 인산염이다. 많은 요로 감염을 치료하는 데 도움이 되는 일부 인산염들은 소변을 더 산성으로 만드는 데 사용된다. 요로에서 칼슘 결석의 형성을 피하기 위해 일부 인산염들이 사용된다.[5] 매일 식사를 통해 충분한 인을 섭취할 수 없는 환자의 경우 일반적으로 특정 장애 또는 질병 때문에 인산염이 식이 보충제로 사용된다.[5] 주사제 인산염은 의료인들만 다룰 수 있다.[5]
식물의 물질대사
편집식물은 수지상균근 경로 및 직접 흡수 경로 같은 여러 경로를 통해 인을 흡수한다.
건강에 좋지 않은 영향
편집고인산혈증 또는 혈액 내 높은 수준의 인산염은 일반 인구의 사망률 증가와 관련이 있다. 고인산혈증은 일반적으로 음식에 자연적으로 존재하는 인산염의 경우 위장관을 통해 완전히 흡수되지 않기 때문에 인산염 첨가제, 즉 식품 제제에 첨가되는 인산염에 의해 발생한다. 인산염은 혈관의 석회화를 유발하고 혈액 내 고농도의 인산염은 심혈관계 질환의 예측 인자인 것으로 밝혀졌다.[6]
인산염은 일반적으로 가공 식품 및 패스트푸드에 첨가제로 사용된다. 패스트푸드와 즉석 가공 식품은 사람들의 인산염 소비 증가의 주요 원인이다. 인산염 첨가제는 향이 첨가된 청량 음료와 특정 유제품에서도 흔히 발견할 수 있다.[6]
생산
편집지질학적 생성
편집인산염은 많은 인산염 광물에서 발견되는 인 원소의 자연적인 존재 형태이다. 광물학 및 지질학에서 인산염은 인산염 이온을 포함하고 있는 암석 또는 광석을 지칭한다. 무기 인산염은 농업과 산업에서 사용하기 위한 인을 얻기 위해 채굴된다.[2]
인산염의 세계 최대 생산 및 수출국은 모로코이다. 북미에서 가장 큰 매장지는 플로리다주 중부의 본 밸리 지역, 아이다호주 남동부의 소다 스프링스 지역, 노스캐롤라이나주 해안이다. 보다 적은 양의 매장지는 몬태나주, 테네시주, 조지아주 및 사우스캐롤라이나주에 위치해 있다. 작은 섬나라인 나우루와 그 이웃인 바나바섬은 최고 품질의 인산염 매장량이 많았던 곳으로 과도하게 채굴되었었다. 인광석은 또한 대규모 인산염 채굴 산업이 있는 국가인 이집트, 이스라엘, 팔레스타인, 서사하라, 나배사섬, 튀니지, 토고, 요르단에서도 찾아볼 수 있다.
인광석 광산은 다음의 지역에서 찾아볼 수 있다.
- 북아메리카: 미국은 특히 플로리다주에 매장량이 많고, 노스캐롤라이나주, 아이다호주, 테네시주는 상대적으로 매장량이 플로리다주보다는 적다.
- 아프리카: 모로코, 알제리, 이집트, 니제르, 세네갈, 토고, 튀니지
- 중동: 이스라엘, 사우디아라비아, 요르단, 시리아, 이란, 이라크, 요르단 국경 근처의 아카샤트 마을
- 중앙아시아: 카자흐스탄
- 오세아니아: 오스트레일리아, 마카테아, 나우루, 바나바섬
2007년을 기준으로 현재의 속도로 인을 소비하면 345년 후에 인이 고갈될 것으로 추정되었다.[7] 그러나 일부 과학자들은 "인 생산 정점"이 30년 내에 일어날 것으로 예상하고 있으며, 지속 가능한 미래 연구소의 다나 코델은 "현재의 속도로는 매장량이 향후 50~100년 내에 고갈될 것"이라고 말했다.[8] 매장량은 현재 시장 가격으로 회수 가능한 것으로 추정되는 양을 말하며, 2012년에 미국 지질조사국은 전세계 매장량을 710억톤으로 추정했으며, 2011년에는 전세계적으로 1억 9000만톤이 채굴되었다.[9] 인은 암석의 평균 질량의 0.1%를 차지[10](반면에 초목에서의 전형적인 농도는 0.03~0.2%이다)[11]하며, 결과적으로 지구의 3 × 1019톤[12]의 지각에는 수천억 톤의 인이 존재하지만, 조사를 통해 계산된 매장량보다 훨씬 낮은 농도이며 추출 비용이 저렴하다. 인산염이 함유된 인산염 광물이 수산화인회석과 플루오린화인회석이라고 가정하면, 인산염 광물은 중량 기준으로 대략 18.5%의 인을 함유하게 되며, 인광석이 이러한 광물을 약 20% 정도 함유한다면, 평균적인 인광석은 중량 기준으로 대략 3.7%의 인을 함유하게 된다.
플로리다주 멀버리의 일부 인산염 암석 퇴적물은 상당한 양의 방사성 우라늄 동위원소를 포함하고 있는 것으로 유명하다.[13] 이것은 생성된 인산염 비료를 사용하는 과정에서 방사능이 지표수로 방출될 수 있기 때문에[14] 중요(예를 들어 미국 남동부의 많은 담배 농장에서)하다.
2012년 12월에 코민코 리소스는 531 Mt의 콩고 브라자빌에 힌다 프로젝트의 업데이트된 광물 자원 분류 준수 자원을 발표하여 세계에서 가장 큰 인산염 매장량을 기록하게 되었다.[15]
채굴
편집3대 주요 인산염 생산국(중국, 모로코, 미국)은 전세계 생산량의 약 70%를 차지한다.
| 국가명 | 생산량 (백만 kg) |
전세계 생산량 점유율 (%) |
매장량 (백만 kg) |
|---|---|---|---|
| 알제리 | 1,300 | 0.54 | 2,200,000 |
| 오스트레일리아 | 2,700 | 1.17 | 1,100,000 |
| 브라질 | 4,700 | 3.00 | 1,600,000 |
| 중화인민공화국 | 95,000 | 44.83 | 3,200,000 |
| 이집트 | 5,000 | 2.47 | 2,800,000 |
| 핀란드 | 995 | - | 1,000,000 |
| 인도 | 1,480 | 0.49 | 46,000 |
| 이라크 | 200 | 0.09 | 430,000 |
| 이스라엘 | 2,810 | 1.48 | 57,000 |
| 요르단 | 9,220 | 3.36 | 800,000 |
| 카자흐스탄 | 1,500 | 0.72 | 260,000 |
| 멕시코 | 558 | 0.76 | 30,000 |
| 모로코 및 서사하라 | 35,500 | 13.45 | 50,000,000 |
| 페루 | 4,000 | 1.79 | 210,000 |
| 러시아 | 13,100 | 5.60 | 600,000 |
| 사우디아라비아 | 6,500 | 1.48 | 1,400,000 |
| 세네갈 | 3,420 | 0.45 | 50,000 |
| 남아프리카 공화국 | 2,100 | 0.99 | 1,400,000 |
| 시리아 | 2,000 | 0.34 | 1,800,000 |
| 토고 | 800 | 0.45 | 30,000 |
| 튀니지 | 4,110 | 1.79 | 100,000 |
| 우즈베키스탄 | 900 | - | 100,000 |
| 미국 | 23,300 | 12.37 | 1,000,000 |
| 베트남 | 4,650 | 1.21 | 30,000 |
| 기타 국가 | 1,140 | 1.17 | 840,000 |
| 합계 | 227,000 | 100 | 71,000,000 |
생태학
편집생태학적 측면에서 인산염은 생물학적 시스템에서 중요한 역할을 하기 때문에 매우 수요가 많은 자원이다. 일단 사용되면 환경에서 제한적인 영양소가 되는 경우가 많으며 그 가용성이 생물체의 성장 속도를 좌우할 수 있다. 이것은 일반적으로 담수 환경에 해당되는 반면, 질소는 해양(해수) 환경에서 제한적인 영양소가 되는 경우가 더 많다. 일반적으로 드문 환경 및 미시 환경에 높은 수준의 인산염을 추가하면 생태학적으로 심각한 결과를 초래할 수 있다. 예를 들어 일부 생물 개체군이 다른 생물 개체군을 희생시키면서 번성하고, 산소와 같은 자원이 부족하게 된 개체군의 붕괴(부영양화 참조)가 발생할 수 있다. 오염과 관련하여 인산염은 수질의 주요 지표인 총용존 고형물의 구성 요소이지만, 모든 인이 조류가 분해하여 소비할 수 있는 분자 형태인 것은 아니다.[17]
칼슘 수산화인회석과 방해석 침전물은 충적층 표토의 세균 주위에서 발견할 수 있다.[18] 점토 광물은 생물광화를 촉진하기 때문에 세균과 점토 광물의 존재는 칼슘 수산화인회석과 방해석의 침전을 초래한다.[18]
인산염 침전물에는 상당한 양의 자연 발생 중금속이 포함될 수 있다. 인광석을 처리하는 채광 작업은 높은 수준의 카드뮴, 납, 니켈, 구리, 크로뮴, 우라늄을 포함하는 광미 더미를 남길 수 있다. 주의 깊게 관리하지 않으면 이러한 폐기물은 중금속을 지하수나 인근 강어귀로 침출시킬 수 있다. 식물과 해양 생물이 이러한 폐기물을 흡수하면 식품에 독석 중금속이 농축될 수 있다.[19]
같이 보기
편집- 피로인산염 – (P
2O
7)4− - 폴리인산염 – (HPO
3)
n - 메타인산염 – (POn
3) - 비료
- 하이포아인산염 – H
2(PO
2)− - 유기 인 화합물
- 인산염 – OP(OR)3, (예: 트라이페닐 인산)
- 인산염 피막 처리
- 인산염 소다, 소다 음료수
- 포스핀산염 – OP(OR)R2
- 포스핀 – PR3
- 포스핀 옥사이드 – OPR3
- 아포스핀산염 – P(OR)R2
- 아인산염 – P(OR)3
- 인산부생석고
- 포스폰산염 – OP(OR)2R
- 아포스폰산염 – P(OR)2R
- 인산화
- 인산 이암모늄 – (NH4)2HPO4
- 인산 이나트륨 – Na2HPO4
- 인산 일나트륨 – NaH2PO4
- 삼인산 나트륨 – Na5P3O10
- 울드 압둔 분지
각주
편집- ↑ “Phosphates – PubChem Public Chemical Database”. 《The PubChem Project》. USA: National Center of Biotechnology Information.
- ↑ 가 나 “Phosphate Primer”. 《Florida Industrial and Phosphate Research Institute》. Florida Polytechnic University. 2017년 8월 29일에 원본 문서에서 보존된 문서. 2018년 3월 30일에 확인함.
- ↑ Campbell, Neil A.; Reece, Jane B. (2005). 《Biology》 Seven판. San Francisco, California: Benjamin Cummings. 65쪽. ISBN 0-8053-7171-0.
- ↑ Kipton J. Powell, Paul L. Brown, Robert H. Byrne, Tamás Gajda, Glenn Hefter, Staffan Sjöberg, Hans Wanner (2005): "Chemical speciation of environmentally significant heavy metals with inorganic ligands. Part 1: The Hg2+
, Cl−, OH−, CO2−
3, SO2−
4, and PO3−
4 aqueous systems". Pure and Applied Chemistry, volume 77, issue 4, pages 739–800. doi 10.1351/pac200577040739 - ↑ 가 나 다 “Phosphate Supplement (Oral Route, Parenteral Route) Description and Brand Names - Mayo Clinic”. 《www.mayoclinic.org》. 2020년 11월 20일에 확인함.
- ↑ 가 나 Ritz, Eberhard; Hahn, Kai; Ketteler, Markus; Kuhlmann, Martin K.; Mann, Johannes (January 2012). “Phosphate additives in food--a health risk”. 《Deutsches Ärzteblatt International》 109 (4): 49–55. doi:10.3238/arztebl.2012.0049. ISSN 1866-0452. PMC 3278747. PMID 22334826.
- ↑ Reilly, Michael (2007년 5월 26일). “How Long Will it Last?”. 《New Scientist》 194 (2605): 38–9. Bibcode:2007NewSc.194...38R. doi:10.1016/S0262-4079(07)61508-5.
- ↑ Leo Lewis (2008년 6월 23일). “Scientists warn of lack of vital phosphorus as biofuels raise demand”. 《The Times》.
- ↑ U.S. Geological Survey Phosphate Rock
- ↑ U.S. Geological Survey “Phosphorus Soil Samples” (PDF).
- ↑ Floor Anthoni. “Abundance of Elements”. Seafriends.org.nz. 2013년 1월 10일에 확인함.
- ↑ American Geophysical Union, Fall Meeting 2007, abstract #V33A-1161. Mass and Composition of the Continental Crust
- ↑ 《Central Florida Phosphate Industry: Environmental Impact Statement》 2. United States. Environmental Protection Agency. 1979.
- ↑ C. Michael Hogan (2010). 〈Water pollution〉. Mark McGinley and C. Cleveland (Washington, DC.: National Council for Science and the Environment). 《Encyclopedia of Earth》. 2010년 9월 16일에 원본 문서에서 보존된 문서.
- ↑ “Updated Hinda Resource Announcement: Now world's largest phosphate deposit (04/12/2012)”. Cominco Resources. 2016년 10월 5일에 원본 문서에서 보존된 문서. 2013년 5월 3일에 확인함.
- ↑ “PHOSPHATE ROCK, usgs” (PDF).
- ↑ Hochanadel, Dave (2010년 12월 10일). “Limited amount of total phosphorus actually feeds algae, study finds”. Lake Scientist. 2012년 6월 10일에 확인함.
[B]ioavailable phosphorus – phosphorus that can be utilized by plants and bacteria – is only a fraction of the total, according to Michael Brett, a UW engineering professor ...
- ↑ 가 나 Schmittner KE, Giresse P (1999). “Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils, Roussillon, France”. 《Sedimentology》 46 (3): 463–76. Bibcode:1999Sedim..46..463S. doi:10.1046/j.1365-3091.1999.00224.x.
- ↑ Gnandi, K.; Tchangbedjil, G.; Killil, K.; Babal, G.; Abbel, E. (March 2006). “The Impact of Phosphate Mine Tailings on the Bioaccumulation of Heavy Metals in Marine Fish and Crustaceans from the Coastal Zone of Togo”. 《Mine Water and the Environment》 25 (1): 56–62. doi:10.1007/s10230-006-0108-4. S2CID 129497587.
외부 링크
편집- US Minerals Databrowser provides data graphics covering consumption, production, imports, exports and price for phosphate and 86 other minerals
- Phosphate: analyte monograph – The Association for Clinical Biochemistry and Laboratory Medicine

![[H 2PO 4]− 인산 이수소](http://up.wiki.x.io/wikipedia/commons/thumb/d/db/2-dihydrogenphosphate-3D-balls.png/152px-2-dihydrogenphosphate-3D-balls.png)
![[HPO 4]2− 인산 수소](http://up.wiki.x.io/wikipedia/commons/thumb/8/87/1-hydrogenphosphate-3D-balls.png/123px-1-hydrogenphosphate-3D-balls.png)
![[PO 4]3− 인산염](http://up.wiki.x.io/wikipedia/commons/thumb/b/b0/0-phosphate-3D-balls.png/120px-0-phosphate-3D-balls.png)