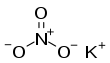질산 칼륨
화합물
질산 칼륨(Potassium nitrate)은 화학식이 KNO3인 무기 화합물로, 칼륨이온 K+과 질산염이온 NO3-으로 만들어진 염이다. 초석(硝石)이라고도 한다.

| |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
Potassium nitrate
| |||
| 별칭 | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.926 | ||
| EC 번호 |
| ||
| E 번호 | E252 (방부제) | ||
| KEGG | |||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | 1486 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| KNO3 | |||
| 몰 질량 | 101.1032 g/mol | ||
| 겉보기 | 백색 고체 | ||
| 냄새 | 무취 | ||
| 밀도 | 2.109 g/cm3 (16 °C) | ||
| 녹는점 | 334 °C (633 °F; 607 K) | ||
| 끓는점 | 400 °C (752 °F; 673 K) (decomposes) | ||
| 133 g/L (0 °C) 316 g/L (20 °C) 383 g/L (25 °C) 2439 g/L (100 °C)[3] | |||
| 용해도 | slightly soluble in 에탄올 soluble in 글리세롤, 암모니아 | ||
| 염기도 (pKb) | 15.3[4] | ||
자화율 (χ)
|
−33.7·10−6 cm3/mol | ||
굴절률 (nD)
|
1.335, 1.5056, 1.5604 | ||
| 구조 | |||
| 사방정계, en:Aragonite | |||
| 열화학 | |||
열용량 (C)
|
95.06 J/mol K | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
-494.00 kJ/mol | ||
| 위험 | |||
| 주요 위험 | Oxidant, harmful if swallowed, inhaled, or absorbed on skin. Causes irritation to skin and eye area. | ||
| 물질 안전 보건 자료 | ICSC 0184 | ||
| GHS 그림문자 |  
| ||
| H272, H315, H319, H335 | |||
| P102, P210, P220, P221, P280 | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | non-flammable (oxidizer) | ||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LD50 (median dose)
|
1901 mg/kg (oral, rabbit) 3750 mg/kg (oral, rat)[5] | ||
| 관련 화합물 | |||
다른 음이온
|
en:Potassium nitrite | ||
다른 양이온
|
en:Lithium nitrate 질산 나트륨 en:Rubidium nitrate en:Caesium nitrate | ||
관련 화합물
|
en:Potassium sulfate 염화 칼륨 | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
흡입 및 피부 접촉 시 유해하며 눈에 접촉 시 다량의 붕산과 물로 씻어야 한다.
이용
편집질산 칼륨은 치약 및 화약을 만드는데 쓰인다. 질산 칼륨과 설탕, 그리고 베이킹 소다(탄산수소 나트륨)를 섞어 불을 붙이면 연기가 난다. 이는 '스모크 밤(Smoke bomb)'으로 이용된다.
같이 보기
편집각주
편집- ↑ Record of Potassium nitrate in the GESTIS Substance Database of the Institute for Occupational Safety and Health, accessed on 2007-03-09.
- ↑ Gustafson, A. F. (1949). 《Handbook of Fertilizers - Their Sources, Make-Up, Effects, And Use》. 25쪽. ISBN 9781473384521. 2017년 2월 17일에 원본 문서에서 보존된 문서.
- ↑ B. J. Kosanke; B. Sturman; K. Kosanke; I. von Maltitz; T. Shimizu; M. A. Wilson; N. Kubota; C. Jennings-White; D. Chapman (2004). 〈2〉. 《Pyrotechnic Chemistry》. Journal of Pyrotechnics. 5–6쪽. ISBN 978-1-889526-15-7. 2016년 5월 5일에 원본 문서에서 보존된 문서.
- ↑ Kolthoff, Treatise on Analytical Chemistry, New York, Interscience Encyclopedia, Inc., 1959.
- ↑ chem.sis.nlm.nih.gov 보관됨 2014-08-12 - 웨이백 머신
외부 링크
편집| 이 글은 화학에 관한 토막글입니다. 여러분의 지식으로 알차게 문서를 완성해 갑시다. |