탄산 칼륨
혼합물
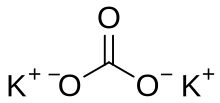
탄산 칼륨(문화어: 탄산칼리움[2], 영어: Potassium carbonate, K2CO3)은 물에 녹는 하얀 빛깔의 칼륨 탄산염으로, 알칼리 용액을 만들어낸다. 취하며 쓴 맛이 난다. 수소이온지수는 11.6pH이고 녹는점은 891도이다. 탄산 칼륨은 다른 소화성 물질에 비해 염분이 높은 성질이 있다.
| |

| |

| |
| 이름 | |
|---|---|
| IUPAC 이름
Potassium carbonate
| |
| 별칭
Carbonate of potash, dipotassium carbonate, sub-carbonate of potash, pearl ash, potash, salt of tartar, salt of wormwood.
| |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.008.665 |
| E 번호 | E501(i) (산도 조절제, ...) |
PubChem CID
|
|
| RTECS 번호 |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| K 2CO 3 | |
| 몰 질량 | 138.205 g/mol |
| 겉보기 | White, hygroscopic solid |
| 밀도 | 2.43 g/cm3 |
| 녹는점 | 891 °C (1,636 °F; 1,164 K) |
| 끓는점 | Decomposes |
| 110.3 g/100 mL (20 °C) 149.2 g/100 mL (100 °C) | |
| 용해도 | |
자화율 (χ)
|
−59.0·10−6 cm3/mol |
| 위험 | |
| 물질 안전 보건 자료 | ICSC 1588 |
| GHS 그림문자 | 
|
| 신호어 | 경고 |
| H302, H315, H319, H335 | |
| P261, P305+351+338 | |
| NFPA 704 (파이어 다이아몬드) | |
| 인화점 | Non-flammable |
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |
LD50 (median dose)
|
1870 mg/kg (oral, rat)[1] |
| 관련 화합물 | |
다른 음이온
|
Potassium bicarbonate |
다른 양이온
|
Lithium carbonate Sodium carbonate Rubidium carbonate Caesium carbonate |
관련 화합물
|
Ammonium carbonate |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
공업 생산
편집탄산 칼륨은 다음의 과정을 통해 생성된다.
- 2KOH + CO2 → K2CO3 + H2O
각주
편집- ↑ Chambers, Michael. “ChemIDplus - 584-08-7 - BWHMMNNQKKPAPP-UHFFFAOYSA-L - Potassium carbonate [USP] - Similar structures search, synonyms, formulas, resource links, and other chemical information.”. 《chem.sis.nlm.nih.gov》. 2014년 8월 12일에 원본 문서에서 보존된 문서.
- ↑ 평양 1999년 3월 19일발 조선중앙통신: "그 방법은 소성로먼지 가운데서 탄산칼리움을 포집하여 물로 우려낸 다음... "
외부 링크
편집| 이 글은 화학에 관한 토막글입니다. 여러분의 지식으로 알차게 문서를 완성해 갑시다. |
