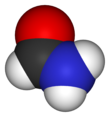
폼아마이드
화합물
(포름아마이드에서 넘어옴)
폼아마이드(영어: formamide) 또는 메탄아마이드(영어: methanamide)는 포름산에서 나오는 아마이드이다. 물과 섞일 수 있으며 암모니아와 같은 냄새가 나는 투명한 액체이다. 의약품, 다른 의약품, 제초제, 살충제 및 시안화 수소산의 제조를 위한 화학 원료로 쓰이며, 종이와 섬유의 연화제로 사용되어 왔다. 또 여러가지 이온화합물에 용매로 쓰이며, 수지 및 가소제의 용제로도 사용되었다.
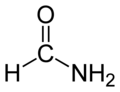
| |||
| |||
| 이름 | |||
|---|---|---|---|
| 우선명 (PIN)
formamide[1] | |||
| 체계명
methanamide | |||
| 별칭
carbamaldehyde
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.766 | ||
| KEGG | |||
PubChem CID
|
|||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| CH3NO | |||
| 몰 질량 | 45.04 g/mol | ||
| 겉보기 | 무색, 유성 액체[2] | ||
| 밀도 | 1.133 g/cm3 | ||
| 녹는점 | 2 to 3 °C (36 to 37 °F; 275 to 276 K) | ||
| 끓는점 | 210 °C (410 °F; 483 K) | ||
| 혼화성 | |||
| 증기 압력 | 0.08 mmHg at 20 °C | ||
| 산성도 (pKa) | 23.5 (in DMSO)[3] | ||
자화율 (χ)
|
−2.19×10−5 cm3/mol | ||
| 위험 | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | 154 °C (309 °F; 427 K) (closed cup) | ||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용)
|
none[2] | ||
REL (권장)
|
TWA 10 ppm (15 mg/m3) [skin][2] | ||
IDLH (직접적 위험)
|
N.D.[2] | ||
| 관련 화합물 | |||
관련 화합물
|
카밤산 다이메틸폼아마이드 | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
분해
편집포름아미드는 시안화 수소 (HCN)와 물의 흔적과 함께 180 ℃에서 부분적으로 일산화탄소와 암모니아로 분해되기 시작한다. 고체 산 촉매의 존재 하에서, 포름아미드는 사이안화 수소를 고수율로 산출한다.
- 저온 : HCONH2 → CO + NH3
- 고온, 산촉매 : HCONH2 → HCN + H2 생산
생성
편집과거에는 포름산을 암모니아로 처리하여 암모늄 포름산염을 생성시키고 암모늄 포름산염은 가열시 포름아미드를 생성한다. HCOOH + NH3 → HCOONH4,HCOONH4 → HCONH2 + H2O 포름 아미드는 또한 에틸 포르 메이트의 아미노 분해에 의해 생성된다.
- HCOOCH2CH3 + NH3 → HCONH2 + CH3CH2OH
다른 2단계 공정은 일산화탄소와 메탄올로부터 형성되는 포름산 메틸의 아미노 분해를 포함한다 :
- CO + CH3OH → HCOOCH3
- HCO2CH3 + NH3 → HC (O) NH2 + CH3OH
같이 보기
편집각주
편집- ↑ 《Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)》. Cambridge: The Royal Society of Chemistry. 2014. 841쪽. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The traditional name ‘formamide’ is retained for HCO-NH2 and is the preferred IUPAC name.
- ↑ 가 나 다 라 NIOSH Pocket Guide to Chemical Hazards. “#0295”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ F. G. Bordwell; J. E. Bartmess; J. A. Hautala (1978). “Alkyl effects on equilibrium acidities of carbon acids in protic and dipolar aprotic media and the gas phase”. 《J. Org. Chem.》 43 (16): 3095–3101. doi:10.1021/jo00410a001.