피라졸
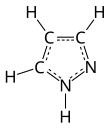
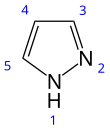
피라졸(영어: pyrazole)은 화학식이 C3H3N2H인 유기 화합물이다. 피라졸은 3개의 탄소 원자와 2개의 인접한 질소 원자로 구성된 5원자 고리를 특징으로 하는 헤테로고리 화합물이다. 피라졸은 약염기이며, pKb는 11.5, 25 °C에서 피라졸의 짝산의 pKa는 2.49이다.[2] 피라졸은 또한 인접한 질소 원자를 갖는 C3N2 고리를 가지고 있는 화합물의 일종이다.[3] 피라졸 고리를 가지고 있는 주목할만한 약물로는 세레콕시브, 아나볼릭 스테로이드인 스타노졸롤이 있다.
| |||
| |||
| 이름 | |||
|---|---|---|---|
| 우선명 (PIN)
1H-pyrazole[1] | |||
| 체계명
1,2-diazacyclopenta-2,4-diene | |||
| 별칭
1,2-diazole
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.005.471 | ||
| KEGG | |||
PubChem CID
|
|||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C3H4N2 | |||
| 몰 질량 | 68.079 g·mol−1 | ||
| 녹는점 | 66–70 °C (151–158 °F; 339–343 K) | ||
| 끓는점 | 186–188 °C (367–370 °F; 459–461 K) | ||
| 염기도 (pKb) | 11.5 | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
제조 및 반응
편집피라졸은 α,β-불포화 알데하이드와 하이드라진의 반응 및 후속적인 탈수소화에 의해 합성된다.[4]
치환된 피라졸은 1,3-다이케톤과 하이드라진과의 축합(크노르-타입 반응)에 의해 제조된다.[5] 예를 들어, 아세틸아세톤은 하이드라진과 반응하여 3,5-다이메틸피라졸을 생성한다.[6]
- CH3C(O)CH2C(O)CH3 + N2H4 → (CH3)2C3HN2H + 2 H2O
역사
편집피라졸이라는 용어는 1883년에 독일의 화학자 루드비히 크노르가 처음으로 사용하였다.[7] 1898년에 독일의 화학자 한스 폰 페크만이 개발한 고전적인 방법에서, 피라졸은 아세틸렌과 다이아조메테인으로부터 합성되었다.[8]
스코피오네이트로의 전환
편집피라졸은 수소화붕소 칼륨과 반응하여 스코피오네이트로 알려진 부류의 리간드를 형성한다. 피라졸 자체는 고온(약 200 °C)에서 수소화붕소 칼륨과 반응하여 트리스피라졸릴보레이트 리간드(Tp 리간드)로 알려진 세자리 리간드를 형성한다.
3,5-다이페닐-1H-피라졸
편집3,5-다이페닐-1H-피라졸은 (E)-1,3-다이페닐프로프-2-엔-1-온이 황[9] 또는 과황산 나트륨[10]의 존재하에서 하이드라진과 반응하여 생성된다. 또는 3,5-다이페닐-1H-피라졸은 하이드라존을 사용하여 생성될 수도 있는데, 이 경우에는 부산물로 아진이 생성된다.[11]
생성 및 용도
편집1959년에 천연 피라졸인 1-피라졸릴-알라닌이 수박 씨앗에서 최초로 분리되었다.[12][13]
피라졸 고리 구조는 펜피록시메이트, 피프로닐, 테부펜피라드, 톨펜피라드를 포함한 살진균제, 살충제, 제초제와 같은 다양한 농약류에서 발견된다.[15] 피라졸 부분은 미국 식품의약국에 의해 저분자 약물에 가장 많이 사용되는 고리 구조로 목록에 올라가 있다.[16]
같이 보기
편집- 3,5-다이메틸피라졸
- 이미다졸 – 1번과 3번 위치에 질소 원자를 가지고 있는 피라졸의 유사체
- 아이소옥사졸 – 1번 위치의 질소 원자가 산소 원자로 치환된 피라졸의 유사체
각주
편집- ↑ 〈Front Matter〉. 《Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)》. Cambridge: The Royal Society of Chemistry. 2014. 141쪽. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ↑ “Dissociation constants of organic acids and bases” (PDF). 2018년 11월 1일에 원본 문서 (PDF)에서 보존된 문서. 2020년 11월 27일에 확인함.
- ↑ Eicher, T.; Hauptmann, S. (2003). 《The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications》 2판. Wiley-VCH. ISBN 3-527-30720-6.
- ↑ Schmidt, Andreas; Dreger, Andrij (2011). “Recent Advances in the Chemistry of Pyrazoles. Properties, Biological Activities, and Syntheses”. 《Curr. Org. Chem.》 15 (9): 1423–1463. doi:10.2174/138527211795378263.
- ↑ Nozari, M., Addison, A., Reeves, G.T, Zeller, M., Jasinski, J.P., Kaur, M., Gilbert, J. G., Hamilton, C. R., Popovitch, J. M., Wolf, L. M., Crist, L. E., Bastida, N., (2018) Journal of heterocyclic Chemistry 55, 6, 1291-1307. https://doi.org/10.1002/jhet.3155
- ↑ Johnson, William S.; Highet, Robert J. (1963). “3,5-Dimethylpyrazole”. 《Organic Syntheses》.; 《Collective Volume》 4, 351쪽
- ↑ Knorr, L. (1883). “Action of ethyl acetoacetate on phenylhydrazine. I”. 《Chemische Berichte》 16: 2597–2599. doi:10.1002/cber.188301602194.
- ↑ von Pechmann, Hans (1898). “Pyrazol aus Acetylen und Diazomethan”. 《Berichte der deutschen chemischen Gesellschaft》 (독일어) 31 (3): 2950–2951. doi:10.1002/cber.18980310363.
- ↑ Outirite, Moha; Lebrini, Mounim; Lagrenée, Michel; Bentiss, Fouad (2008). “New one step synthesis of 3,5-disubstituted pyrazoles under microwave irradiation and classical heating”. 《Journal of Heterocyclic Chemistry》 45 (2): 503–505. doi:10.1002/jhet.5570450231.
- ↑ Zhang, Ze; Tan, Ya-Jun; Wang, Chun-Shan; Wu, Hao-Hao (2014). “One-pot synthesis of 3,5-diphenyl-1H-pyrazoles from chalcones and hydrazine under mechanochemical ball milling”. 《Heterocycles》 89 (1): 103–112. doi:10.3987/COM-13-12867.
- ↑ Lasri, Jamal; Ismail, Ali I. (2018). “Metal-free and FeCl3-catalyzed synthesis of azines and 3,5-diphenyl-1H-pyrazole from hydrazones and/or ketones monitored by high resolution ESI+-MS”. 《Indian Journal of Chemistry, Section B》 57B (3): 362–373.
- ↑ Fowden; Noe; Ridd; White (1959). 《Proc. Chem. Soc.》: 131.
|제목=이(가) 없거나 비었음 (도움말) - ↑ Noe, F. F.; Fowden, L.; Richmond, P. T. (1959). “alpha-Amino-beta-(pyrazolyl-N) propionic acid: a new amino-acid from Citrullus vulgaris (water melon)”. 《Nature》 184 (4688): 69–70. Bibcode:1959Natur.184...69B. doi:10.1038/184069a0. PMID 13804343. S2CID 37499048.
- ↑ Faria, Jéssica Venância; Vegi, Percilene Fazolin; Miguita, Ana Gabriella Carvalho; dos Santos, Maurício Silva; Boechat, Nubia; Bernardino, Alice Maria Rolim (2017년 11월 1일). “Recently reported biological activities of pyrazole compounds”. 《Bioorganic & Medicinal Chemistry》 25 (21): 5891–5903. doi:10.1016/j.bmc.2017.09.035. ISSN 0968-0896. PMID 28988624.
- ↑ FAO
- ↑ Taylor, R. D.; MacCoss, M.; Lawson, A. D. G. J Med Chem 2014, 57, 5845.
더 읽을거리
편집- A. Schmidt; A. Dreger (2011). “Recent Advances in the Chemistry of Pyrazoles. Part 2. Reactions and N-Heterocyclic Carbenes of Pyrazole”. 《Curr. Org. Chem.》 15 (16): 2897–2970. doi:10.2174/138527211796378497.