하이드라진
하이드라진(영어: hydrazine) 또는 히드라진은 로켓 연료로 사용되는 액체 화학물질로 화학식은 N2H4이다. 암모니아 유사한 냄새가 난다. 물과 유사한 밀도를 가지며, 또한 물과 비슷한 온도 범위에서 액체 상태로 존재한다.
| |||
| |||
 Anhydrous hydrazine
| |||
| 이름 | |||
|---|---|---|---|
| 체계명
Hydrazine[2] | |||
| 별칭 | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| 3DMet | |||
| 878137 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.005.560 | ||
| EC 번호 |
| ||
| 190 | |||
| KEGG | |||
| MeSH | Hydrazine | ||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | 2029 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| N 2H 4 | |||
| 몰 질량 | 32.0452 g·mol−1 | ||
| 겉보기 | Colorless, fuming, oily liquid[3] | ||
| 냄새 | Ammonia-like[3] | ||
| 밀도 | 1.021 g·cm−3 | ||
| 녹는점 | 2 °C; 35 °F; 275 K | ||
| 끓는점 | 114 °C; 237 °F; 387 K | ||
| Miscible[3] | |||
| log P | 0.67 | ||
| 증기 압력 | 1 kPa (at 30.7 °C) | ||
| 산성도 (pKa) | 8.10 (N2H5+)[4] | ||
| 염기도 (pKb) | 5.90 | ||
| 짝산 | Hydrazinium | ||
굴절률 (nD)
|
1.46044 (at 22 °C) | ||
| 점도 | 0.876 cP | ||
| 구조 | |||
| Triangular pyramidal at N | |||
| 1.85 D[5] | |||
| 열화학 | |||
표준 몰 엔트로피 (S
|
121.52 J·K−1·mol−1 | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
50.63 kJ·mol−1 | ||
| 위험 | |||
| 물질 안전 보건 자료 | ICSC 0281 | ||
| GHS 그림문자 |     
| ||
| 신호어 | 위험 | ||
| H226, H301, H311, H314, H317, H331, H350, H410 | |||
| P201, P261, P273, P280, P301+310, P305+351+338 | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | 52 °C (126 °F; 325 K) | ||
| 24 to 270 °C (75 to 518 °F; 297 to 543 K) | |||
| 폭발 한계 | 1.8–99.99% | ||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LD50 (median dose)
|
59–60 mg/kg (oral in rats, mice)[6] | ||
LC50 (median concentration)
|
260 ppm (rat, 4 hr) 630 ppm (rat, 1 hr) 570 ppm (rat, 4 hr) 252 ppm (mouse, 4 hr)[7] | ||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용)
|
TWA 1 ppm (1.3 mg/m3) [skin][3] | ||
REL (권장)
|
Ca C 0.03 ppm (0.04 mg/m3) [2-hour][3] | ||
IDLH (직접적 위험)
|
Ca [50 ppm][3] | ||
| 관련 화합물 | |||
다른 음이온
|
Tetrafluorohydrazine Hydrogen peroxide Diphosphane Diphosphorus tetraiodide | ||
다른 양이온
|
Organic hydrazines | ||
관련 Binary azanes
|
Ammonia Triazane | ||
관련 화합물
|
Diazene Triazene Tetrazene Diphosphene | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
발연성이 높아 로켓의 연료로 사용되며, F-16 전투기의 EPU(Emergency Power Unit)의 연료로도 사용된다.
인체 발암성이 높고 호흡기, 피부 등에 영향을 미칠 수 있는 유독성의 물질로서, 이 물질의 위험성으로 인해 컬럼비아 우주왕복선 폭발 사고 당시 지상에 떨어진 파편에 일반인들이 접근하지 말 것이 당국에 의해 권고되기도 하였다.
본래 하이드라진은 일반적 명명법을 이용하여 명명해야 하지만 기존에 하이드라진이 사용되고 있었기 때문에 명명 대상에서 제외되고 관용명이 사용되고 있다.
분자 구조 및 성질
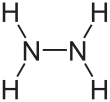
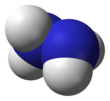
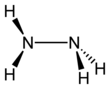
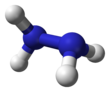
편집하이드라진의 구조는 암모니아 분자에서 분자 하나 당 수소를 하나씩 뺀 것을 두 개 쌍으로 만든 구조이다. 각각의 H2N-N는 피라미드 구조이다. N-N 거리(distance)는 1.45 Å이며, 분자는 고시 형태(Gauche conformation, 빗놓인 형태)를 보여주고 있다.[8] 회전 장벽값은 에테인의 회전 장벽값의 두 배이다. 하이드라진의 구조적 성질은, 비스듬하게 어긋난 형태를 보여주며 회전 장벽값이 높은 기체 상태의 과산화 수소의 구조적 성질과 유사하다.
하이드라진은 염기 성질을 보여주나, 암모니아보다는 15분의 1 정도로 약하다.m;j
- N2H4 + H2O → [N2H5]+ + OH- Kb = 1.3 x 10-6
(암모니아에서는, Kb = 1.78 x 10-5) 하이드라진은 어렵사리 다이프로톤화될 수 있다.:[9]
- [N2H5]+ + H2O → [N2H6]2+ + OH- Kb = 8.4 x 10-16
같이 보기
편집각주
편집- ↑ “NIOSH Guide—Hydrazine”. Centers for Disease Control. 2012년 8월 16일에 확인함.
- ↑ 가 나 “hydrazine—PubChem Public Chemical Database”. 《The PubChem Project》. USA: National Center for Biotechnology Information.
- ↑ 가 나 다 라 마 바 NIOSH Pocket Guide to Chemical Hazards. “#0329”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ Hall HK, 외. (1957). “Correlation of the Base Strengths of Amines1”. 《J. Am. Chem. Soc.》 79 (20): 5441. doi:10.1021/ja01577a030.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). 《Chemistry of the Elements》 2판. Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Martel B, Cassidy K, 외. (2004). 《Chemical Risk Analysis: A Practical Handbook》. Amsterdam: Butterworth–Heinemann. 361쪽. ISBN 9781903996652. OCLC 939257974.
- ↑ “Hydrazine”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).
- ↑ Miessler, Gary L. and Tarr, Donald A. Inorganic Chemistry, Third Edition. Pearson Prentice Hall (2004). ISBN 0-13-035471-6.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
외부 링크
편집- 위키미디어 공용에 하이드라진 관련 미디어 분류가 있습니다.