테노포비르 디소프록실
테노포비르 디소프록실(Tenofovir disoproxil)은 상품명 비리어드(Viread )로 판매되며, 만성 B형간염을 치료하고 HIV/AIDS를 예방 및 치료하는데 사용되는 약물이다.[1]일반적으로 다른 항레트로 바이러스제제와 함께 사용하는 것이 좋다.[1] 노출전 고 위험군의 HIV/AIDS예방에 사용할 수 있으며, 바늘에 찔린 부상이나 기타 잠재적 노출 후에 사용할 수 있다.[1] 테노포비르 디소프록실(Tenofovir disoproxil)은 그 자체로 판매되거나 엠트리시타빈(emtricitabine)/테노포비르(Tenofovir) 그리고 에파비렌즈(efavirenz)/엠트리시타빈(emtricitabine)/테노포비르(Tenofovir)로서 함께 판매된다.[1]이 약물은 HIV/AIDS 또는 B형 간염을 치료하지는 않는다.[1][2] 이 약물은 정제 또는 분말 제형으로 구입 가능하다.[1]
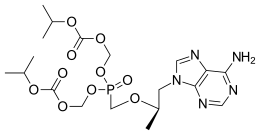
| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
| Bis{[(isopropoxycarbonyl)oxy]methyl} ({[(2R)-1-(6-amino-9H-purin-9-yl)-2-propanyl]oxy}methyl)phosphonate | |
| 식별 정보 | |
| CAS 등록번호 | 201341-05-1 |
| ATC 코드 | J05AF07 |
| PubChem | 5481350 |
| 드러그뱅크 | DB00300 |
| ChemSpider | 4587262 |
| 화학적 성질 | |
| 화학식 | C19H30N5O10P |
| 분자량 | ? |
| 유의어 | Tenofovir disoproxil fumarate, Bis(POC)PMPA |
| 약동학 정보 | |
| 생체적합성 | 25% |
| 동등생물의약품 | ? |
| 약물 대사 | ? |
| 생물학적 반감기 | ? |
| 배출 | ? |
| 처방 주의사항 | |
| 허가 정보 | |
| 임부투여안전성 | B3(오스트레일리아) |
| 법적 상태 | |
| 투여 방법 | By mouth (tablets) |
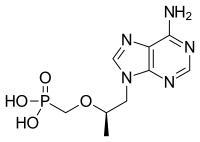
| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
| ({[(2R)-1-(6-amino-9H-purin-9-yl)propan-2-yl]oxy}methyl)phosphonic acid | |
| 식별 정보 | |
| CAS 등록번호 | 147127-20-6 |
| ATC 코드 | none |
| PubChem | 464205 |
| 드러그뱅크 | DB00300 |
| ChemSpider | 408154 |
| 화학적 성질 | |
| 화학식 | C9H14N5O4P |
| 분자량 | ? |
| SMILES | eMolecules & PubChem |
| 유의어 | 9-(2-Phosphonyl-methoxypropyly)adenine (PMPA) |
| 약동학 정보 | |
| 생체적합성 | ? |
| 단백질 결합 | < 1% |
| 동등생물의약품 | ? |
| 약물 대사 | ? |
| 생물학적 반감기 | 17 hours |
| 배출 | Kidney |
| 처방 주의사항 | |
| 임부투여안전성 | ? |
| 법적 상태 | |
| 투여 방법 | By mouth |
일반적인 부작용으로는 메스꺼움, 발진, 설사, 투동, 통증, 우울증, 쇠약이 있다.[1] 심각한 부작용으로는 젖산혈증과 간비대가 있다.[1] 절대 금기사항은 없다.[1] 종종 임신 중에 권장되며 안전한 것으로 보인다.[1]
이 약물은 뉴클레오티드 역전사 효소 저해제로 복제하는 바이러스 능력을 억제함으로써 작동한다.[1] 테노포비르는 1996년 특허를 획득하였으며, 미국에서 2001년 사용승인이 났다.[3] 이것은 세계 보건기구(WHO)의 필수 의약품 목록에 포함된다.[4] 2017년부터 제네릭 의약품으로 이용이 가능해 졌다.[5]
의료용 사용
편집테노포비르 디소프록실(Tenofovir disoproxil)은 HIV-1감염 및 만성 B형 간염 치료에 사용된다. HIV-1감염의 경우 테노포비르는 2세 이상에게서 다른 항레트로바이러스제와 함께 사용된다. 만성 B형 간염 환자의 경우 12세 이상의 환자에게 사용된다.[6]
HIV 위험 감소
편집테노포비르(Tenofovir)는 성병이나 주사 약물 사용을 통해 감염 위험이 높은 사람들의 HIV 예방에 사용될 수 있다. 코크란 리뷰는 사전 노출 HIV예방을 위한 테노포비르(Tenofovir)의 사용을 조사한 결과, 테노포비르(Tenofovir) 단독과 테노포비르(Tenofovir)/엠트리시타빈(emtricitabine) 조합 모두 고위험 환자의 HIV감염위험을 감소시키는 것으로 나타났다.[7]
미국 질병 통제 예방 센터(CDC)는 태국 공중 보건부와 협력하여 불법적으로 약물을 주사하는 사람들에게 예방 조치로 테노포비르(Tenofovir)의 일일 복용량을 제공하는 효과를 확인하는 연구를 수행하였다.
그 결과, 위약을 투여 받은 대조군에 비해 약물을 투여 받은 피험자 그룹에서 바이러스 발생률이 48.9%감소한 것으로 나타났다.[8]
부작용
편집테노포비르 디소프록실(Tenofovir disoproxil)은 일반적으로 HIV 및 B형 간염 환자 집단에서 낮은 중단률을 보여 내약성이 좋다.[9]
이 약의 사용에 대한 금기사항은 없다.[6]
테노포비르 디소프록실(Tenofovir disoproxil) 사용으로 인한 가장 일반적으로 보고된 부작용은 현기증, 메스꺼움, 설사다.[9]
기타 부작용으로는 우울증, 수면장애, 두통, 가령무증, 발진, 발열 등이 있다. 미국에서 테노포비르 디소프록실(Tenofovir disoproxil)의 상자에 붙은 경고로는 테노포비르 디소프록실(Tenofovir disoproxil) 사용으로 인한 젖산혈증 또는 간 손상의 잠재적 발병 가능성이 있다.[10]
테노포비르 디소프록실(Tenofovir disoproxil)의 장기간 사용은 신독성 및 뼈손실과 관련이 있다. 신독성은 판코니증후군, 급서 신장 손상 또는 사구체 여과율(GFR)감소로 나타날 수 있다.[11]
테노포비르 디소프록실(Tenofovir disoproxil)을 중단하면 신부전을 되돌릴 가능성이 있다. 테노포비르 디소프록실(Tenofovir disoproxil)의 근위 세뇨관 축적으로 신장 독성이 생길수 있고, 이로 인해 테노포비르 디소프록실(Tenofovir disoproxil)의 혈청 농도가 상승 할 수 있다.[9]
상호작용
편집테노포비르(Tenofovir)는 디다노신(didanosine) 및 HIV-1 프로티아제 억제제와 상호작용한다. 테노포비르(Tenofovir)는 디다노신(didanosine) 농도를 증가시키고 췌장염 및 신경병증과 같은 부작용을 일으킬 수 있다. 테노포비르(Tenofovir)는 역시 HIV-1프로테아제 억제제인 아타자나비르(Atazanavir)와 상호작용하여 아타자나비르(Atazanavir)의 농도를 감소시키면서 테노포비르(Tenofovir)의 농도는 증가한다.[6] 또한, 테노포비르(Tenofovir)는 신장배설 되기 때문에, 신장 기능을 손상시키는 약물도 문제를 일으킬 수 있다.
약물학
편집행동의 매커니즘
편집테노포비르 디소프록실(Tenofovir disoproxil)은 뉴클레오티드 아날로그 역전사 효소 억제제(NtRTI)다.[12] 인간 면역결핍 바이러스(HIV)와 같은 레트로 바이러스에서 중요한 역전사 효소를 선택적으로 억제하여 인간 효소인 DNA 폴리머레이즈 α, β, 미토콘드리아 DNA 폴리머레이즈 γ[6][12] 에 대한 억제는 최소로 나타난다.
생체내 테노포비르 디소프록실 퓨마레이트(Tenofovir disoproxil fumarate)는 테노포비르(Tenofovir)로 전환되어, 디옥시아데노신5'-일인산 (d-AMP)의 비고리형 유사체가 된다. 테노포비르(Tenofovir)는 d-AMP의 3'탄소에 해당하는 위치에 하이드록시기가 없어서 DNA 사슬 연장에 필수적인 5'에서 3'으로의 인산다이에스테르 결합 형성이 되지 않는다.[12] 테노포비르(Tenofovir)가 연장되고 있는 DNA가닥의 끝에 붙으면, DNA 역전사의 조기 종결을 유발하여 바이러스 복제를 방지한다.[12]
약물동태학
편집테노포비르 디소프록실(Tenofovir disoproxil)은 장에서 빠르게 흡수되고 절단되어 테노포비르(Tenofovir)가 되는 전구약물이다.[6] 세포 내에서, 테노포비르(Tenofovir)는 인산화되어 테노포비르 디포스페이트(Tenofovir diphosphate)(자체에 하나의 인산기가 있기 때문에 테노포비르 디포스페이트는 삼인산과 유사)가 되면 활성화합물로 작용해 사슬 종결로 역전[13][12] 시킨다.
금식하는 사람들에게서 생체이용률은 25%이며, 1시간 후에 가장 높은 혈장 농도에 도달한다.[12] 지방음식을 섭취하면, 최고 혈장농도가 2시간 이후에 도달하며, 곡선하면적(AUC)은 40%증가한다.[12] 또한 시토크롬 P450 1A2의 억제제다.[14]
테노포비르(Tenofovir)는 주로 신장으로 배설되며, 사구체 여과와 OA5T1, OAT3, ABCC4를 통한 세뇨관 분비를 통해 배설된다.[13]
역사
편집테노포비르(Tenofovir)는 처음에 프라하에 있는 체코 슬로바키아 아카데미의 유기 화학 및 생화학 연구소의 Antonín Holý에 의해 합성되었다. Antonín Holý가 1984년에 제출한 특허[15]에는 1년 전에 발견된 HIV감염 치료를 위한 화합물의 잠재적인 사용에 대한 언급은 없었다.
1985년 De Clercq와 Holý는 세포 배양에서 HIV에 대한 PMPA의 활성을 설명했다.[16] 그 후 곧, 생명공학 회사인 길리어드 사이언스와 대한 치료제로 PMPA의 잠재력을 조사하였다. 1997년 길리어드와 캘리포니아대학의 연구자들은 테노포비르(Tenofovir)가 피하주사로 투여 될 때, 사람의 생체내에서 항 HIV효과를 나타낸 다는 것을 증명했다.[17]
이 연구에서 테노포비르(Tenofovir)의 초기 형태는 세포에 잘 침투하지 못하고 경구 투여시 흡수되지 않았기 때문에 광범위하게 사용될 가능성이 제한적이였다. 길리어드는 테노포비르(Tenofovir)의 전구약물인 테노포비르 디소프록실(tenofovir disoproxil)을 개발 하였고, 이 버전이 종종 단순히 "테노포비르(Tenofovir)"라고 불린다. 전구약물의 형태에서는, 테노포비르(Tenofovir)의 두 인산기가 마스킹되어 구강흡수가 상향되었다.
테노포비르 디소프록실(Tenofovir disoproxil)은 2001년 미국에서 HIV치료용으로 승인되어 2008년에는 만성 B형 간염 치료용으로 승인이 되었다.[18][19]
약물 형태
편집테노포비르 디소프록실(Tenofovir disoproxil)은 경구로 복용가능하고 상품명 비리어드(Viread)로 판매되고 있다.[20]
테노포비르 디소프록실(Tenofovir disoproxil)은 테노포비르 포스페이트(tenofovir phosphonate)의 전구약물 형태로 세포 내로 유입되어 테노포비르 다이포스페이트(tenofovir Diphosphonate)로 전환된다.[21] 길리어드 사이언스에서 판매된다.(푸마레이트 염 형태. 약칭 TDF).[22]
테노포비르 디소프록실(Tenofovir disoproxil)은 여러 항 바이러스 약물을 단일용량으로 결합한 정제로도 제공된다. 잘 알려진 조합으로는 아트리플라(atripla)(tenofovir disoproxil/emtricitabine/efavirenz), 콤플레라(Complera) (tenofovir disoproxil/emtricitabine/rilpivirine), 스트리빌드(stribild) (tenofovir disoproxil/emtricitabine/elvitegravir/cobicistat), 트루바다(Tenofovirr disoproxil/emtricitabine)가 있다.[20]
길리어드는 활성약물인 테노포비르 다이포스페이트(tenofovir Diphosphonate)의 두번째 전구약물인 테노포비르 알라페나미드(tenofovir alafenamide)를 만들었다. 이 약물은 림프 세포에서의 활성화로 인해 테노포비르 디소프록실(Tenofovir disoproxil)과는 활성대사 산물이 해당 세포에 축적되어 전신 조출 및 잠재적 독성을 낮출수 있게 되었다.[9]
화학
편집테노포비르(Tenofovir)의 녹는점은 279 °C (534 °F)다.[23] 테노포비르 디소프록실 푸마레이트(Tenofovir disoproxil fumarate)는 메탄올에 용해되고 물에는 약간 용해(13.4 mg/ml[24])되고, 디클로로메탄[25]에서는 매우 약간 용해되는 흰색에서 회백색의 결정성 분말이다.
체엑에서의 감지
편집테노포비르(Tenofovir)는 액체 크로마토 그래피로 혈장에서 측정할 수 있다. 이러한 검사는 치료를 모니터링하고 신장 또는 간에 문제가 있는 사람들의 약물 축적 및 독성을예방하는 데 유용하다.[26][27][28]
각주
편집- ↑ 가 나 다 라 마 바 사 아 자 차 카 “Tenofovir Disoproxil Fumarate”. The American Society of Health-System Pharmacists. 2016년 11월 30일에 원본 문서에서 보존된 문서. 2016년 11월 29일에 확인함.
- ↑ Kearney BP, Yale K, Shah J, Zhong L, Flaherty JF (2006). “Pharmacokinetics and dosing recommendations of tenofovir disoproxil fumarate in hepatic or renal impairment”. 《Clinical Pharmacokinetics》 45 (11): 1115–24. doi:10.2165/00003088-200645110-00005. PMID 17048975. S2CID 6322957.
- ↑ R. Baselt, Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, California, 2008, pp. 1490–1492.
- ↑ World Health Organization (2019). 《World Health Organization model list of essential medicines: 21st list 2019》. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ “Teva Announces Exclusive Launch of a Generic version of Viread in the United States”. 《www.tevapharm.com》. 2018년 11월 6일에 원본 문서에서 보존된 문서. 2021년 6월 23일에 확인함.
- ↑ 가 나 다 라 마 Gilead Sciences, Inc. Prescribing Information. 보관됨 2013-02-07 - 웨이백 머신 Revised: November 2012.
- ↑ Okwundu CI, Uthman OA, Okoromah CA (July 2012). “Antiretroviral pre-exposure prophylaxis (PrEP) for preventing HIV in high-risk individuals”. 《The Cochrane Database of Systematic Reviews》 7 (7): CD007189. doi:10.1002/14651858.CD007189.pub3. PMID 22786505.
- ↑ Emma Bourke (2013년 6월 14일). “Preventive drug could reduce HIV transmission among injecting drug users”. 《The Conversation Australia》. The Conversation Media Group. 2013년 11월 1일에 원본 문서에서 보존된 문서. 2013년 6월 17일에 확인함.
- ↑ 가 나 다 라 Ustianowski A, Arends JE (June 2015). “Tenofovir: What We Have Learnt After 7.5 Million Person-Years of Use”. 《Infectious Diseases and Therapy》 4 (2): 145–57. doi:10.1007/s40121-015-0070-1. PMC 4471058. PMID 26032649.
- ↑ “Tenofovir: MedlinePlus Drug Information”. 《medlineplus.gov》. 2016년 11월 10일에 원본 문서에서 보존된 문서. 2016년 11월 9일에 확인함.
- ↑ Morlat P, Vivot A, Vandenhende MA, Dauchy FA, Asselineau J, Déti E, Gerard Y, Lazaro E, Duffau P, Neau D, Bonnet F, Chêne G (2013년 6월 12일). “Role of traditional risk factors and antiretroviral drugs in the incidence of chronic kidney disease, ANRS CO3 Aquitaine cohort, France, 2004-2012”. 《PLOS ONE》 8 (6): e66223. Bibcode:2013PLoSO...866223M. doi:10.1371/journal.pone.0066223. PMC 3680439. PMID 23776637.
- ↑ 가 나 다 라 마 바 사 Drugbank: Tenofovir 보관됨 2015-09-08 - 웨이백 머신
- ↑ 가 나 Haberfeld, H, 편집. (2015). 《Austria-Codex》 (독일어). Vienna: Österreichischer Apothekerverlag.
- ↑ Pubchem. “Tenofovir disoproxil”. 《pubchem.ncbi.nlm.nih.gov》 (영어). 2018년 4월 17일에 확인함.
- ↑ “Patent US4808716 - 9-(phosponylmethoxyalkyl) adenines, the method of preparation and ... - Google Patents”. 2014년 5월 9일에 원본 문서에서 보존된 문서.
- ↑ A US 4724233 A, De Clercq, Erik; Antonin Holy & Ivan Rosenberg, "Therapeutical application of phosphonylmethoxyalkyl adenines"
- ↑ Deeks SG, Barditch-Crovo P, Lietman PS, Hwang F, Cundy KC, Rooney JF, Hellmann NS, Safrin S, Kahn JO (September 1998). “Safety, pharmacokinetics, and antiretroviral activity of intravenous 9-[2-(R)-(Phosphonomethoxy)propyl]adenine, a novel anti-human immunodeficiency virus (HIV) therapy, in HIV-infected adults”. 《Antimicrobial Agents and Chemotherapy》 42 (9): 2380–4. doi:10.1128/aac.42.9.2380. PMC 105837. PMID 9736567.
- ↑ FDA letter of approval (regarding treatment of hepatitis B) 보관됨 2009-02-25 - 웨이백 머신
- ↑ FDA Clears Viread for Hepatitis B 보관됨 2017-09-08 - 웨이백 머신
- ↑ 가 나 “Drugs@FDA: FDA Approved Drug Products”. 《www.accessdata.fda.gov》. 2016년 11월 10일에 원본 문서에서 보존된 문서. 2016년 11월 9일에 확인함.
- ↑ Mouton JP, Cohen K, Maartens G (November 2016). “Key toxicity issues with the WHO-recommended first-line antiretroviral therapy regimen”. 《Expert Review of Clinical Pharmacology》 9 (11): 1493–1503. doi:10.1080/17512433.2016.1221760. PMID 27498720. S2CID 205930751.
- ↑ Emau P, Jiang Y, Agy MB, Tian B, Bekele G, Tsai CC (November 2006). “Post-exposure prophylaxis for SIV revisited: animal model for HIV prevention”. 《AIDS Research and Therapy》 3: 29. doi:10.1186/1742-6405-3-29. PMC 1687192. PMID 17132170.
- ↑ Dinnendahl, V; Fricke, U, 편집. (2011). 《Arzneistoff-Profile》 (독일어) 9 25판. Eschborn, Germany: Govi Pharmazeutischer Verlag. ISBN 978-3-7741-9846-3.
- ↑ “AIDSinfo Drug Database: Tenofovir disoproxil fumarate”. National Institutes of Health. 2017년 4월 28일에 원본 문서에서 보존된 문서. 2016년 8월 4일에 확인함.
- ↑ “Tenofovir disoproxil fumarate” (PDF). World Health Organization. June 2010. 2016년 8월 8일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ Delahunty T, Bushman L, Robbins B, Fletcher CV (July 2009). “The simultaneous assay of tenofovir and emtricitabine in plasma using LC/MS/MS and isotopically labeled internal standards”. 《Journal of Chromatography B》 877 (20–21): 1907–14. doi:10.1016/j.jchromb.2009.05.029. PMC 2714254. PMID 19493710.
- ↑ Kearney BP, Yale K, Shah J, Zhong L, Flaherty JF (2006). “Pharmacokinetics and dosing recommendations of tenofovir disoproxil fumarate in hepatic or renal impairment”. 《Clinical Pharmacokinetics》 45 (11): 1115–24. doi:10.2165/00003088-200645110-00005. PMID 17048975. S2CID 6322957.
- ↑ R. Baselt, Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, California, 2008, pp. 1490–1492.
외부 링크
편집- “Tenofovir disoproxil”. 《Drug Information Portal》. U.S. National Library of Medicine.
- “Tenofovir disoproxil fumarate”. 《Drug Information Portal》. U.S. National Library of Medicine.