텅스텐
텅스텐(문화어: 탕그스텐←스웨덴어: Tungsten 퉁스텐[*], 일본어: タングステン 탕구스텐[*]) 또는 볼프람(문화어: 월프람←독일어: Wolfram)은 화학 원소로 기호는 W(←라틴어: Wolframium 볼프라미움[*]), 원자 번호는 74이다. 텅스텐이라는 말은 스웨덴어로 '무거운 돌'을 의미하기[1][2] 때문에 한자어로 중석(重石)이라고도 부른다. 무겁고 매우 단단한 전이 금속으로 철망가니즈중석과 회중석 등의 광석에서 산출된다. 1781년에 처음 발견되어 1783년에 순수한 형태로 분리되었다. 금속원소들 중 녹는점이 가장 높으며, 밀도는 19.3g/cm3으로 금이나 우라늄과 비슷하다. 순수한 텅스텐은 단단하면서도 연성이 뛰어나며, 불순물이 소량 첨가되면 단단하지만 부서지기 쉬워 가공하기 어려워진다.
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 개요 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영어명 | Tungsten | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 표준 원자량 (Ar, standard) | 183.84(1) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표 정보 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 74 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 족 | 6족 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기 | 6주기 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 구역 | d-구역 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 화학 계열 | 전이 금속 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전자 배열 | [Xe] 4f14 5d4 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
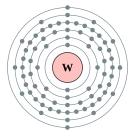
| 준위별 전자 수 | 2, 8, 18, 32, 12, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리적 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 겉보기 | 회백색 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 상태 (STP) | 고체 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 녹는점 | 3695 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 끓는점 | 5828 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (상온 근처) | 19.25 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융해열 | 52.31 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기화열 | 806.7 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 몰열용량 | 24.27 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 증기 압력 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | 6, 5, 4, 3, 2 (약산성 산화물) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 (폴링 척도) | 2.36 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 135 pm (실험값) 193 pm (계산값) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 공유 반지름 | 146 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그 밖의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 | 체심 입방정계 (bcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 음속 (얇은 막대) | (단조됨) 4620 m/s (실온) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열팽창 | 4.5 µm/(m·K) (25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열전도율 | 173 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 저항도 | 52.8 n Ω·m (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 영률 | 411 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전단 탄성 계수 | 161 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 부피 탄성 계수 | 310 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 푸아송 비 | 0.28 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 모스 굳기계 | 7.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 비커스 굳기 | 3430 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 브리넬 굳기 | 2570 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7440-33-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

순수한 텅스텐은 전기·전자 분야에 쓰이지만 주로 화합물이나 합금으로 널리 쓰인다. 전구의 필라멘트가 가장 대표적이다. 또, 텅스텐은 단단하고 밀도가 높으므로 군용 목적으로는 전차의 장갑을 뚫는 탄에도 많이 활용된다.
특성
편집물리적 특성
편집순수한 텅스텐은 은회색의 광택을 가지는 단단한 금속으로, 전성과 연성이 뛰어나 가공하기가 쉽다. 그러나 불순물이 약간 섞이면 단단하면서도 부서지기 쉬워지는 단점이 있다.
텅스텐은 모든 원소들 중 녹는점이 가장 높고(3422 °C) 1650 °C 이상에서 증기압이 가장 낮은 원소이기도 하다. 비록 탄소가 고체 상태로 존재하는 온도가 더 높기는 하지만 탄소는 약 4027 °C에서 액체 상태를 거치지 않고 바로 기체로 승화하기 때문에 녹는점이 가장 높은 원소는 텅스텐이다. 또, 텅스텐의 인장 강도는 모든 원소들 중에서 가장 높은데 이는 5d 오비탈의 전자들이 텅스텐 원자들을 서로 강하게 결합시키고 있기 때문이다. 따라서 강철에 약간의 텅스텐을 첨가하면 그 강도가 매우 높아진다. (탄화텅스텐(WC)은 가장 강한 물질중 하나(질화붕소(BN), 탄화텅스텐(WC), 질화규소(Si₃N₄))이다. )
텅스텐의 안정된 동위원소는 Tungsten - 180(99.99491974285%+), Tungsten - 182, Tungsten - 183, Tungsten - 184, Tungsten - 186 이고, 텅스텐의 모든 알려진 동위원소는 Tungsten - 158 ~ Tungsten - 192 (35가지)이다. {이 문단 업데이트 날짜는 2019년 2월 11일임}
또한, 텅스텐은 두 종류의 원자 배열을 가진다. 하나는 α 텅스텐으로 체심 입방정계 구조이며, 텅스텐 구조들 중 가장 안정하다. β 텅스텐은 A15 등축정계 구조를 갖는데 준안정하며, 일반적인 상태에서 α 구조일 때와 함께 존재할 수 있다. α 구조는 전기 저항이 β 구조일 때의 1/3이며, 초전도체가 되는 임계온도는 약 0.015K로 β 구조일 때 1~4K인 것보다 낮다. 두 종류의 구조를 혼합하면 그 중간 정도의 임계온도를 나타낸다. 텅스텐과 다른 금속을 혼합하여 만든 합금은 그보다도 더 높은 임계온도를 나타내는데, 이들은 저온 초전도체 회로에 사용된다. 대표적인 예로 텅스텐-테크네튬 합금이 있다.
생물학적 특성
편집원자 번호 74번인 텅스텐은 생물학적 역할이 있다고 알려진 원소들 중 가장 무거운 원소로, 진핵생물을 제외한 일부 세균들이 사용한다. 텅스텐을 사용하는 효소들은 일반적으로 카르복시산을 알데하이드로 환원시키는 역할을 한다. 산화 환원 효소들의 경우 산화 반응의 촉매로 사용하기도 한다. 텅스텐을 필요로 하는 일부 효소의 경우 셀레늄도 함께 필요로 하는 경우가 있는데, 이러한 조합은 몰리브데넘-황의 조합과 비슷한 역할을 한다.
또한, 텅스텐은 토양 속에서 산화하여 양이온이 된다. 이러한 텅스텐 양이온은 토양 속에 사는 원핵생물들이 특정 효소 내에서 몰리브데넘 대체용으로 사용하기도 한다. 토양의 산성도에 따라 텅스텐이 중합되는 정도가 달라지기도 한다. 일반적으로 토양이 산성일 경우 텅스텐 중합체가 잘 형성된다.
역사
편집텅스텐은 1781년 칼 빌헬름 셸레가 발견하였다. 당시 그는 회중석에서 얻을 수 있는 텅스텐산을 처음으로 발견하고는 이 산을 환원시켜 새로운 금속 원소를 얻을 수 있을 것이라고 예측했다. 1783년에는 엘야르 형제(Jose Elhuyar, Fausto Elhuyar)가 철망가니즈중석에서 같은 물질을 발견하였고 이를 목탄으로 환원시켜 순수한 텅스텐을 발견하였다.
제2차 세계대전 동안에는 텅스텐이 군사적으로 중요한 역할을 하였다. 텅스텐은 높은 온도에서도 잘 견디고 다른 금속과 섞으면 강도가 높아지는 성질이 있어 군용으로 많이 사용된다. 이 때문에 당시 유럽 내 주요 산지였던 포르투갈은 파나스케이라 지방의 철망가니즈중석 자원 때문에 연합국과 추축국 모두로부터 압력을 받기도 하였으나, 동시에 이득을 취하기도 하였다.
한편, 텅스텐이라는 이름은 스웨덴어 tung sten에서 유래한 것인데, 이는 고대 스웨덴어로 회중석을 지칭하는 말이며, '무거운 돌(중석)'이라는 뜻이다. 따라서 텅스텐이라는 이름은 스칸디나비아 지역에서는 사용되지 않는다. 원소 기호 W는 독일어에서 사용되는 이름인 'wolfram'에서 따온 것으로, 늑대라는 뜻이다.
동위 원소
편집자연에는 다섯 종류의 텅스텐 동위 원소가 존재하며, 모두 반감기가 매우 길어 안정한 원소로 분류되는 동위 원소들이다. 이론상으로는 안정한 텅스텐 동위 원소 5가지 모두 알파 붕괴를 통해 하프늄으로 붕괴할 수 있지만 현재까지는 180W만이 약 1.8×1018년의 반감기를 거쳐 방사성 붕괴하는 것이 관찰되었으며, 이는 평균적으로 1년에 1g의 텅스텐 중에서 180W 원자 2개만이 붕괴하는 것과 같다. 다른 안정 동위 원소들은 아직까지 붕괴하는 것이 관찰된 적은 없으며 모두 반감기가 4×1018 이상인 것으로 추정되나 실제로 붕괴하지 않을 수도 있다. 이외에 원자량 158에서 192 사이에 30개의 인공 방사성 동위 원소와 4개의 준안정 동위 원소가 발견되었으며, 이들 중 가장 안정한 것은 반감기 121.2일의 181W이다.
용도
편집고강도 물질
편집전체 텅스텐 생산량의 약 60% 정도는 탄화 텅스텐(WC)를 기반으로 한 고강도 물질의 생산에 이용된다. 이는 탄화물 중 가장 단단한 물질 중의 하나로, 경도는 다이아몬드와 비슷하며 녹는점은 약 2770 °C이다. 매우 단단한 특성을 이용하여 칼, 드릴, 톱 등 절단 용구에 많이 사용된다. 일부는 반지 제조에 사용되기도 한다.
합금
편집텅스텐은 단단하고 밀도가 높아 중금속의 합금에 많이 이용되며, 특히 고강도강은 텅스텐 함량이 18% 정도이다. 녹는점도 매우 높으므로 로켓이나 미사일의 엔진 노즐에도 사용된다. 텅스텐을 철, 니켈, 코발트 등과 혼합하여 만든 합금은 매우 무거우므로 열화 우라늄탄을 대신하여 운동 에너지탄에 사용하기도 한다. 방사능이 문제가 되는 경우 등 열화 우라늄탄을 사용할 수 없는 곳에 주로 사용하며, 이와 비슷하게 포탄의 탄피, 수류탄, 미사일 등에 사용된다. 이밖에도 항공우주공학, 자동차 산업, 방사선 보호 등 텅스텐은 다양한 분야에 널리 사용된다.
기타
편집존재
편집텅스텐은 철망가니즈중석, 회중석 등의 광물에서 주로 산출된다. 2009년 기준으로 중국이 전 세계 생산량의 약 83%에 해당하는 51,000톤을 생산하였으며, 제2차 세계대전 당시에는 미국의 텅스텐 공급에 도움을 주기도 하였다. 이외에 러시아, 캐나다, 볼리비아, 오스트리아, 포르투갈, 태국, 브라질, 페루, 르완다 등에서도 상당량 생산되었으며, 이 중 포르투갈은 제2차 세계대전 당시 중립국이면서도 연합국과 나치 독일 양측 모두에 텅스텐을 판매하여 이득을 보았다.
한국에는 텅스텐이 최소 약 970만톤 ~ 최대 3천만톤(80년 사용 가능한 분량)가량 매장되어 있다고 한다. 강원도 영월군 상동광산은 단일 광구로서는 한때 세계 최대의 광산이었다. 그러나 1990년대 값싼 중국산 텅스텐 유입으로 폐광되었고 대한중석은 거평그룹에 매각되었다.[3] 2020년부터 상동광산 재개광을 추진중이다.[4]
주의사항
편집텅스텐은 자연에서 흔하게 존재하는 원소는 아니며, 대체로 화학적 활성이 적기 때문에 자연에 미치는 영향은 적다. 그러나 일부 수용성의 텅스텐 화합물은 중추 신경계에 영향을 미칠 수도 있으므로 주의해야 한다[5].
같이 보기
편집각주
편집- ↑ “보관된 사본”. 2011년 11월 23일에 원본 문서에서 보존된 문서. 2011년 10월 1일에 확인함.
- ↑ “보관된 사본”. 2011년 11월 23일에 원본 문서에서 보존된 문서. 2011년 10월 1일에 확인함.
- ↑ “대한중석, 거평 소유로 넘어가 민영화”. 《KBS 9시뉴스》. 1994년 2월 28일.
- ↑ 홍정화 기자 (2023년 8월 4일). “알몬티, 상동 텅스텐 광산 개발 본격화…중국 의존도 낮추기”. 《글로벌이코노믹》.
- ↑ United States Department of Labor. “Occupational Safery & Health Administration: Tungsten (as W) Soluble Compounds”. 2014년 7월 28일에 원본 문서에서 보존된 문서. 2014년 7월 23일에 확인함.
외부 링크
편집- “텅스텐”. 《네이버캐스트》.
- (영어) 텅스텐 - WebElements.com
- 텅스텐 사진