마그네슘
마그네슘(영어: Magnesium 매그니지엄[*], 문화어: 마그네시움←독일어: Magnesium 마그네지움[*], 일본어: マグネシウム 마구네시우무[*],한자:鎂)은 알칼리 토금속에 속하는 화학 원소로 기호는 Mg(←라틴어: Magnesium 마그네시움[*])이고 원자 번호는 12이다. 실온에서 은백색의 가벼운 금속으로 존재한다. 반응성이 크고 2가 양이온이 되려는 경향이 있으므로 자연에서는 주로 마그네사이트, 백운암, 활석, 석면 등의 화합물의 형태로 발견된다. 지구의 지각에서는 질량 기준으로 약 2.5%를 차지하여 8번째로 많이 존재하는 원소이며, 우주 전체에서도 8번째로 많이 존재하는 원소이다.[1] 우주에 있는 마그네슘은 주로 3개의 헬륨 원자핵과 1개의 탄소 원자핵이 크고 오래된 별 안에서 핵융합을 함으로써 생성되었다. 해수에는 이온(Mg2+)의 형태로 존재하며, 해수 속 이온 중에서는 염화 이온(Cl-), 나트륨 이온(Na+) 이어 세 번째로 많은 양이다.[2]
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 개요 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영어명 | Magnesium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 표준 원자량 (Ar, standard) | [24.304, 24.307] 24.305 (보편) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표 정보 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 족 | 2족 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기 | 3주기 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 구역 | s-구역 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 화학 계열 | 알칼리 토금속 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전자 배열 | [Ne] 3s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
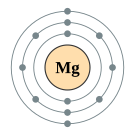
| 준위별 전자 수 | 2, 8, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리적 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 겉보기 | 은빛 흰색 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 상태 (STP) | 고체 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 녹는점 | 923 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 끓는점 | 1363 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (상온 근처) | 1.738 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융해열 | 8.48 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기화열 | 128 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 몰열용량 | 24.869 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 증기 압력 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | 2 (강염기성 산화물) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 (폴링 척도) | 1.31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 150 pm (실험값) 145 pm (계산값) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 공유 반지름 | 130 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 판데르발스 반지름 | 173 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그 밖의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 | 육방정계 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 음속 (얇은 막대) | (단련된) 4940 m/s (실온) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열팽창 | 24.8 µm/(m·K) (25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열전도율 | 156 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 저항도 | 43.9 n Ω·m (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자기 정렬 | 상자성 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 영률 | 45 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전단 탄성 계수 | 17 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 부피 탄성 계수 | 45 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 푸아송 비 | 0.29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 모스 굳기계 | 2.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 브리넬 굳기 | 560 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7439-95-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

주로 해수에서 얻은 염화 마그네슘(MgCl2)을 전기분해하여 얻거나 마그네사이트, 백운암 등의 광물에서 얻는다. 인체 내에서는 11번째로 많이 존재하는 원소이며, 300여가지 효소들과 모든 세포에게 필수적인 원소이다. 마그네슘은 세포 내에서 인산기를 가지는 DNA, RNA, ATP 등의 물질을 생성하고 수백가지의 효소들이 작용하는 데 관여한다. 또한 탄수화물 대사 과정에서 촉매로 작용하므로 생명 활동에 중요한 역할을 한다. 식물의 엽록소에도 마그네슘 이온이 포함되어 있어 광합성에 중요한 역할을 한다. 마그네슘 화합물들은 의학적으로 변비약, 제산제(예시: 마그네시아 유제, milk of Magnesia), 비정상적인 신경 자극 또는 혈관 경련을 안정화하는 데 사용된다.
성질
편집물리적 성질
편집마그네슘은 은백색의 가벼운 금속이며 녹는점은 650°C, 끓는점은 1090°C이다. 밀도는 1.738 g/cm3이다.결정 구조는 육방 밀집 구조이며, 연성과 전성이 있어 얇은 박 또는 철사 등으로 뽑을 수 있다. 또, 낮은 밀도에 비해 단단하여 구조재로 사용되며 특히 알루미늄, 아연, 망가니즈, 철 등과의 합금은 낮은 밀도에 비해 경도가 높고 내식성이 뛰어나 항공기, 자동차 등 다양한 분야에서 사용된다.[3] 공기 중에서는 잘 발화하지 않지만 미세한 분말이나 얇은 선으로 만들면 자외선 영역의 빛을 포함하는 흰색의 밝은 불꽃을 내며 연소하며, 이 때 불꽃의 온도는 3,100 °C에 이를 수 있다.[4] 이러한 특성을 이용하여 카메라 조명이나 불꽃놀이, 섬광탄 등에 사용되며, 소이탄에 첨가되기도 하였다.
화학적 성질
편집마그네슘은 1s22s22p63s2의 전자배치를 가지며, 3s 오비탈의 전자 2개를 잃고 양이온이 되려는 성질로 인해 주된 산화수는 +2이다.[3] 은백색의 금속이며 알칼리토금속 중에서 가장 낮은 녹는점과 끓는점(녹는점 923 K, 끓는점 1363 K)을 가지고 있다. 순수한 다결정의 마그네슘은 잘 부서진다. 마그네슘은 적은 양의 다른 금속과 합금하면(예:1 % 알루미늄 합금)더 연성이 커진다. 공기 중에 노출되면 산소와 반응하여 투과성이 작고 제거하기 어려운 산화 피막 을 형성하여 더 이상의 산화를 막는다. 그래서 더 마그네슘보다 더 무거운 알칼리 토금속 원소들과는 달리 마그네슘은 불투과성의 산화피막으로 보호받고 있기 때문에 산소를 차단하는 보관 환경을 따로 필요로 하지 않는다. 마그네슘은 분말이나 얇은 선으로 만들면 위에서 설명한 바와 같이 빠르게 연소하여 강한 백색광을 내며 산화 마그네슘(MgO)과 질화 마그네슘을 형성한다. 대부분의 화합물은 흰색의 이온 결합 물질로, 물에 쉽게 용해되어 쓴맛을 나타낸다.
마그네슘은 반응성이 낮은 질소와 반응하여 질화 마그네슘(Mg3N2)을 형성할 수 있으며, 이산화 탄소와도 반응하여 산화 마그네슘과 탄소를 형성한다.
- 2 Mg + CO2 → 2 MgO + C
할로젠 원소들과도 반응하여 이온 결합 물질을 생성하며, 고온, 고압에서는 수소와도 반응하여 MgH2을 형성하기도 한다. 산소족 원소들과도 1:1 비율로 결합하여 화합물을 만들 수 있으며, 특히 산소와는 과산화물(MgO2)도 형성할 수 있다.[5] 마그네슘은 상온에서 물과 반응하며 칼슘에 비해서는 훨씬 더 천천히 반응한다. 마그네슘이 물과 반응하면 수소 기체와 산화 마그네슘을 형성하며, 과량의 수증기에서는 불용성의 수산화 마그네슘과 수소 기체를 형성한다. 가루 형태로는 더 격렬하게 반응하고 온도가 높을수록 반응이 빨리 진행된다. 반응식은 아래와 같다.
- Mg + 2H2O → Mg(OH)2 + H2
또한, 마그네슘은 묽은 황산이나 염산과 같은 대부분의 산과 발열 반응을 하면서 수소 기체를 발생시키지만 불산과는 반응이 잘 일어나지 않는다.[6] 염기와도 대부분 반응하지 않는데[3][7] 이는 마그네슘의 표면에 불용성의 수산화 마그네슘이 형성되기 때문이다. 염산과 마그네슘의 반응을 예로 들면 반응이 진행되었을 때 염화 마그네슘과 수소 기체를 발생시키게 되는데, 이때 염산과의 반응은 알루미늄, 아연과 같은 다른 많은 금속들과 유사하게 이루어진다.
- 2HCl + Mg → MgCl2 + H2
마그네슘 이온(Mg2+)의 화합물 중 질산 마그네슘(Mg(NO3)2), 염화 마그네슘(MgCl2), 황화 마그네슘(MgS), 황산 마그네슘(MgSO4) 등은 물에 잘 용해되고, 탄산 마그네슘(MgCO3), 수산화 마그네슘(Mg(OH)2) 등은 물에 잘 용해되지 않는다.[8]
생물에서의 역할
편집사람의 몸에서는 칼슘, 인과 함께 뼈의 대사에 중요한 역할을 한다. 또한 식물에서 마그네슘이 부족하면 잎이 누렇게 변하고 죽기도 하여 비료의 주 성분 중 하나이기도 하다.
인체에서의 역할
편집칼슘이 근수축에 필요하고, 마그네슘은 근이완에 필요하다.[9] 칼슘은 세포외액에 많이 있고 마그네슘은 세포내액에 많다.[9] 칼슘과 마그네슘이 세포 내액와 외액 사이를 이동하며 정상적인 근육의 수축이완과 심장박동을 가능하게 한다.[9]
마그네슘은 신경계통의 흥분을 진정시키는데 꼭 필요한 영양소중 하나이다.[9] 칼슘과 더불어 '항스트레스미네랄' 이라고 불리기도 한다.[9] 에너지생성, 영양대사, 신경전도, 뼈와 치아 형성 유지에도 꼭 필요하다.[9]
마그네슘은 변비 치료나 위산과다에 제산제로도 사용되는 의약품 성분이다.[9]
마그네슘 결핍
편집마그네슘은 대부분 뼈를 포함한 조직에 있고, 혈액에는 1% 미만 정도만 있다. 그래서 피검사로 체내 마그네슘이 충분한지 여부를 정확히 알기 어렵다.[9]
마그네슘은 탄산음료, 정제당류, 카페인, 술 등의 섭취로 콩팥을 통해 몸 밖으로 잘 빠져나간다.[9] 또한 "칼슘보충제" 또는 "심장약, 혈압약으로 쓰이는 이뇨제"가 마그네슘 흡수를 감소시킬 수 있다.[9]
마그네슘이 결핍되면 불안, 과민반응, 불면이 나타난다. 또 깊은 잠을 자기가 어려워지고 근경련, 근육 마비나 저림, 눈밑떨림, 얼굴에 통제할 수 없는 경련이 나타난다.[9]
역사
편집마그네슘은 1618년 영국 서리주 엡솜의 한 우물에서 나오는 쓴맛의 물에서 처음 그 존재가 인지되었으며, 나중에 성분이 황산 마그네슘인 것으로 밝혀졌고, 1755년에는 스코틀랜드의 조지프 블랙이 마그네슘을 원소로서 판명하였다. 1808년에는 영국의 험프리 데이비가 산화 마그네슘과 산화 수은의 혼합물을 전기분해하여 얻은 아말감에서 수은을 증발시켜 최초로 마그네슘을 분리하였다.[3][10] 최초에 데이비가 제안한 명칭은 마그늄(영어: magnium)이었으나,[10] 현재는 마그네슘이라는 이름이 쓰이고 있다. 참고로 마그네슘이라는 이름은 그리스 테살리아 지방의 마그네시아에서 나는 마그네시아석의 이름에서 유래하였다. 1828년에는 프랑스의 앙투안 뷔시가 염화 마그네슘(MgCl2)을 칼륨으로 환원시켜 분리하였다.[2] 1833년에는 영국의 마이클 패러데이가 용융된 무수 염화 마그네슘을 전기분해하여 액체 마그네슘을 생산하는 방법을 개발하였다. 이를 바탕으로 1852년에는 독일의 로베르트 분젠이 전기분해 방식을 더 발전시켰으며, 1886년에는 독일에서 최초로 상업적인 생산이 가능해졌다.[11] 제1차 세계 대전과 제2차 세계 대전 때는 군용기와 소이탄 등에 마그네슘 합금이 사용되었다.
존재
편집마그네슘은 우주에서 8번째로 많이 존재하는 원소이며, 지구의 지각에서는 8번째로 풍부한 원소로 지각 질량의 약 2.3%를 차지한다.[12][13] 산화 마그네슘은 지각에서 두 번째로 많은 화합물이다.[14] 주로 마그네사이트, 사문암, 백운암, 활석 등의 형태로 존재하며, 이 밖에도 약 60가지 이상의 광물에서 발견된다. 이러한 광물은 중국, 북조선, 러시아에서 주로 채굴된다.[15]
해수에서는 마그네슘 이온이 약 1.29 g/L 포함되어 있어[16] 이온 수로는 염화 이온(Cl-)과 나트륨 이온(Na+)에 이어 세 번째로 많고 양이온 중에서는 두 번째로 많다. 해수 속 염류 중에서는 염화 마그네슘(MgCl2)이 약 10.9%, 황산 마그네슘이 약 4.7% 포함되어 있어 각각 두 번째, 세 번째로 많은 성분이다.[17] 사람의 몸에서는 11번째로 풍부한 원소로, 약 270 ppm(질량 기준)이 포함되어 있다. 콩, 옥수수, 현미, 정어리 등에 다량 포함되어 있다.
동위 원소
편집마그네슘은 세 종류의 안정 동위 원소가 존재하며, 각각 24Mg, 25Mg, 26Mg이다. 이들 중 존재 비율이 가장 큰 것은 24Mg로, 전체의 약 79%를 차지한다.
26Mg은 전체 마그네슘의 약 11%를 차지하는 동위 원소이며, 26Al이 약 72만 년의 반감기를 거치며 붕괴하여 생성된 핵종이다. 이 점을 이용하여 26Al과 26Mg의 비율은 방사능 연대 측정에 이용되며, 주로 태양계의 역사를 연구하는 데 쓰인다. 25Mg는 전체 마그네슘의 약 10%를 차지하는 동위 원소이다. 26Mg과 함께 인체 내에서 일어나는 마그네슘 대사 과정을 연구할 때 사용되며, 심장 질환의 연구에도 쓰인다.[18] 양전자 방출 단층촬영에 사용되는 22Na의 생산에도 사용된다.
28Mg은 1950년대에서 1970년대 사이에 실험용 원자로에서 흔히 생성되었던 방사성 동위 원소이며, 반감기는 21시간으로 비교적 짧다.
생산
편집마그네슘은 주로 해수에 포함된 여러 가지 염류 중 염화 마그네슘을 분리해내어 용융시킨 후 전기분해하여 얻는다. 우선, 해수에 수산화 칼슘(소석회)를 넣어 염화 마그네슘과 반응시키는데, 반응 결과 수산화 마그네슘이 앙금의 형태로 침전된다. 침전된 수산화 마그네슘을 다시 염산과 반응시키면 염화 마그네슘과 물이 생성되며, 물을 증발시키고 남은 염화 마그네슘을 용융시킨 뒤 전기분해하면 음극에서 순수한 마그네슘을 얻을 수 있다.
- Ca(OH)2 + MgCl2 → Mg(OH)2 + CaCl2
- Mg(OH)2 + 2 HCl → MgCl2 + 2H2O
광물로 산출될 경우, 백운석(MgCa(CO3)2)을 하소시키고 이를 고온에서 규소-철 합금과 반응시켜 얻기도 하며, 이때 철은 촉매로서 작용한다.
- 2MgO + 2 CaO + Si → 2 Mg + Ca2SiO4
이 밖에도 산화 마그네슘과 같은 마그네슘 화합물을 탄소와 같은 환원제와 반응시켜 얻는 방법도 존재한다.[3] 주요 생산국은 중국, 미국, 러시아, 이스라엘, 카자흐스탄, 터키 등이다.[15][19]
이용
편집합금
편집마그네슘은 철과 알루미늄에 이어 세 번째로 많이 사용되는 구조용 금속이자 가장 가벼운 구조용 금속이기도 하다.[2][20] 순수한 마그네슘은 무르기 때문에 주로 합금으로 사용되며, 특히 알루미늄과의 합금을 만드는 데 사용된다.[21] 이 밖에도 강철에서 불순물로 포함된 황 성분을 제거하거나[22] 타이타늄을 생산하기 위한 크롤 법(Kroll process)에서 환원제로 사용되며,[23] 아연과의 합금은 정밀 주조에 사용된다.[24]
마그네슘 합금은 가벼운 성질로 인해 예부터 자동차나 항공기에서 엔진이나 동체 등 여러 부품에 사용되었고, 중량을 줄여 연료 소모를 최소화해야 하는 항공기, 우주선 등 항공우주 분야에서 사용된다.[3][25] 특히, 알루미늄과의 합금은 가공하기 쉽고 가볍기 때문에 항공기, 미사일, 로켓에 사용되며,[26] 같은 이유로 야구에서 포수들이 쓰는 보호 장비와 편자, 골프채, 각종 스포츠 용품, 음료수 캔에도 마그네슘 합금이 사용된다. 또, 방열성과 전자파를 차단하는 성질이 주목받아 휴대 전화, 노트북 컴퓨터, 카메라 등에도 사용되고 있다. 기계의 가공 시간을 단축하게 해주고 동력을 절약해 줄뿐만 아니라 마그네슘 합금으로 만든 공구의 수명도 연장시켜 준다.
화합물
편집마그네슘 화합물은 주로 제산제나 완하제 등 의약품으로 많이 사용되며, 시멘트, 비료, 절연체 등의 생산에도 사용된다.[26][27] 산화 마그네슘(MgO)을 비롯한 여러 가지 마그네슘 화합물은 제철 및 비철 금속의 제련, 유리와 시멘트의 제조에서 용광로의 내화(耐火) 물질로 사용된다. 또, 엽록소의 성분 중 마그네슘을 공급하기 위해 비료로 사용되기도 한다. 산화 마그네슘을 물에 녹이면 불용성의 수산화 마그네슘(Mg(OH)2)이 생성되며, 이는 제산제와 완하제로 사용된다. 아황산 마그네슘(MgSO3)은 종이 제조 공정 중 아황산법에 쓰이며, 황산 마그네슘 7수화물(MgSO4·7H2O)은 공업적으로 시멘트와 비료 생산, 염색에 사용된다.[27] 피부에 생긴 찰과상에 바르는 치료제로 사용된다.[26] 물에 잘 녹지 않는 탄산 마그네슘(MgCO3)은 일부 페인트나 잉크의 제조에 이용되며, 물에 잘 용해되지 않으므로 마그네슘 이온을 포함하는 센물을 보일러 용수로 사용하면 관석의 성분이 될 수 있다. 식염에 첨가하면 수분 흡수를 줄여주기도 하며[26] 그 분말은 습기를 제거하는 데 쓰여 역도 선수나 등반가들이 역기나 암반을 더 잘 잡을 수 있도록 돕는다. 인산 마그네슘(Mg3(PO4)2)은 건축에 사용되는 불연성 목재에 사용되고 플루오린화 마그네슘(MgF2)은 광학 렌즈에 얇게 씌우면 반사를 줄이는 역할을 한다. 브로민화 마그네슘은 진정제로 쓰이며, 붕산 마그네슘, 황산 마그네슘, 살리실산 마그네슘은 소독제로 사용된다. 염화 마그네슘(MgCl2)과 구연산 마그네슘은 마그네슘 보충제 등 의약품으로 사용된다.[28] 두부를 만들 때 사용되는 간수는 황산 마그네슘, 염화 마그네슘 등 여러 가지 마그네슘 화합물을 포함하고 있어 응고시키는 작용을 한다. 또, 할로알케인과 반응시키면 알코올과 같은 여러 가지 유기 물질의 합성에 사용되는 그리냐르 시약(RMgX)을 얻을 수 있다. 이외에도 마그네슘 화합물은 고무와 플라스틱의 제조에 이용되기도 한다.[27]
불꽃놀이 및 조명
편집마그네슘은 산소와 빠르게 반응하여 밝은 흰색 불꽃을 내며, 그 온도는 약 3100 °C까지 올라갈 수 있다. 이러한 이유로 조난 시 구조 신호를 보낼 때 불을 피우는 부싯돌 역할을 할 수 있으며, 불꽃놀이의 불꽃을 낼 때도 마그네슘 분말이 사용된다. 카메라 플래시를 킬 때도 마그네슘 분말이 사용된다.
기타 활용
편집위험성
편집마그네슘 화합물은 대체로 무해하지만 순수한 마그네슘과 그 합금은 용융된 상태이거나 분말, 얇은 박 형태일 때 가연성이 높고 폭발의 위험이 있다. 마그네슘을 연소시키는 실험을 할 때는 항상 보안경을 착용해야 하는데, 이는 연소 시 발생하는 밝은 불꽃에는 자외선 영역의 빛도 포함되어 있어 망막을 손상시킬 위험이 있기 때문이다.[29]
또, 마그네슘은 물과 반응하여 가연성이 큰 수소 기체(H2)를 발생시키고, 이산화 탄소(CO2)와도 반응할 수 있으므로 물이나 이산화 탄소를 이용한 소화기로는 마그네슘에 의한 화재를 진화할 수 없다.[30] 따라서 마그네슘의 연소로 인한 화재는 마른 모래로 덮거나 분말소화기 등을 이용하여 진화해야 한다.
이 밖에도 미세한 마그네슘 분말은 가연성이 매우 크고 공기 중에서 폭발의 위험이 있으며, 노출될 경우 눈이나 호흡기에 자극을 줄 수 있다.[31]
각주
편집- ↑ “10 Most Abundant Elements in the Universe” (영어).
- ↑ 가 나 다 라 마 바 “Encyclopaedia Britannica: 마그네슘”. 2014년 10월 29일에 원본 문서에서 보존된 문서. 2014년 10월 29일에 확인함.
- ↑ Dreizin, Edward L.; Berman, Charles H. and Vicenzi, Edward P. (2000). “Condensed-phase modifications in magnesium particle combustion in air”. 《Scripta Materialia》 122: 30–42. doi:10.1016/S0010-2180(00)00101-2.
- ↑ “Magnesium Compounds” (영어).
- ↑ “Magnesium Encyclopedia - Properties”. 2014년 10월 30일에 원본 문서에서 보존된 문서. 2014년 10월 30일에 확인함.
- ↑ “Chemical reactions of the elements - Magnesium” (영어).
- ↑ 김봉래 외 2 (2006년 7월 1일). 《완자 화학 Ⅰ(1권)》 초판. 비유와상징. 29쪽.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 “칼슘만큼 소중한 마그네슘의 재발견 - 당신의 건강가이드 헬스조선”. 2019년 5월 11일에 확인함.
- ↑ 가 나 Davy, H. (1808). “Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia”. 《Philosophical Transactions of the Royal Society of London》 98: 333–370. Bibcode:1808RSPT...98..333D. doi:10.1098/rstl.1808.0023. JSTOR 107302.
- ↑ Magnesium.com. “Magnesium Encyclopedia - Useful Info”. 2014년 10월 30일에 원본 문서에서 보존된 문서. 2014년 10월 30일에 확인함.
- ↑ “Abundance and form of the most abundant elements in Earth’s continental crust.” (PDF) (영어). 2011년 9월 27일에 원본 문서 (PDF)에서 보존된 문서. 2014년 10월 28일에 확인함.
- ↑ “10 Most Abundant Elements in the Earth's Crust” (영어).
- ↑ Jefferson Lab. “10 Most Abundant Compounds in the Earth's Crust”.
- ↑ 가 나 Royal Society of Chemistry. “Magnesium - Element Information, properties, and uses” (영어).
- ↑ 김찬종 외 11인 (2012년 3월 1일). 《중학교 과학 3》. 두산동아. 319쪽.
- ↑ 김찬종 외 11인 (2012년 3월 1일). 《중학교 과학 3》. 두산동아. 345쪽.
- ↑ “WebElements.com - Isotopes of Magnesium” (영어).
- ↑ “2011 Minerals Yearbook, Magnesium” (PDF). USGS. 2013년 7월 17일에 원본 문서 (PDF)에서 보존된 문서. 2014년 10월 31일에 확인함.
- ↑ “Magnesium Video – The Periodic Table of Videos – University of Nottingham”.
- ↑ magnesium.com. “Magnesium-Aluminum Alloys”. 2014년 10월 31일에 원본 문서에서 보존된 문서. 2014년 10월 31일에 확인함.
- ↑ “Magnesium Alloys Encyclopedia - Introduction”. 2014년 10월 31일에 원본 문서에서 보존된 문서. 2014년 10월 31일에 확인함.
- ↑ Ketil Amundsen, Terje Kr. Aune, Per Bakke, Hans R. Eklund, Johanna Ö. Haagensen, Carlos Nicolas, Christian Rosenkilde, Sia Van den Bremt, Oddmund Wallevik (2002). 〈Magnesium〉. 《Ullmann's Encyclopedia of Industrial Chemistry》. 《Ullmann's Encyclopedia of Industrial Chemistry》. Wiley-VCH. doi:10.1002/14356007.a15_559. ISBN 3527306730.
- ↑ Baker, Hugh D. R.; Avedesian, Michael (1999). 《Magnesium and magnesium alloys》. Materials Park, OH: Materials Information Society. 4쪽. ISBN 0-87170-657-1.
- ↑ Aghion, E.; Bronfin, B. (2000). “Magnesium Alloys Development towards the 21st Century”. 《Materials Science Forum》. 350–351: 19. doi:10.4028/www.scientific.net/MSF.350-351.19.
- ↑ 가 나 다 라 Jefferson Lab. “It's Elemental - Magnesium”. 2013년 5월 18일에 원본 문서에서 보존된 문서. 2014년 10월 31일에 확인함.
- ↑ 가 나 다 “Encyclopaedia Britannica: 마그네슘의 주요화합물”. 2014년 10월 30일에 원본 문서에서 보존된 문서. 2014년 10월 31일에 확인함.
- ↑ 가 나 Mark Winter. “Magnesium - Uses”.
- ↑ “Science Safety: Chapter 8”. Government of Manitoba.
- ↑ “Demo Lab: Reaction Of Magnesium Metal With Carbon Dioxide”.
- ↑ “International Chemical Safety Cards - Magnesium (Powder)”. 2015년 9월 24일에 원본 문서에서 보존된 문서. 2014년 11월 2일에 확인함.
외부 링크
편집- “마그네슘”. 《네이버캐스트》.
- (영어) 마그네슘 - WebElements.com