DNA
DNA(Deoxyribo Nucleic Acid, 데옥시리보핵산, 디옥시리보 핵산)는 뉴클레오타이드의 중합체인 두 개의 긴 가닥이 서로 꼬여있는 이중나선 구조로 되어있는 고분자화합물이다.[1] 세포 핵에서 발견되어 핵산이라는 이름이 붙게 되었지만 미토콘드리아 DNA와 같이 핵 이외의 세포소기관도 독립된 DNA를 갖고 있는 것이 있다.[2]
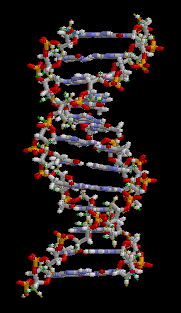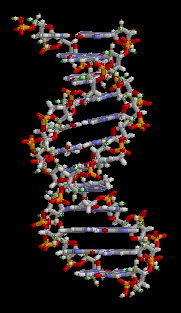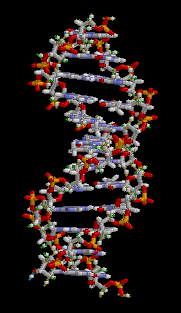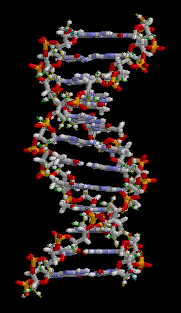
DNA는 4 종류의 뉴클레오타이드가 중합 과정을 통해 연결된 가닥으로 이루어져 있다. 이 가닥은 사이토신, 구아닌, 아데닌, 티민은 독특한 핵염기(nucleobase)로 구분되기 때문에 흔히 DNA 염기서열이라고 부른다.[3] DNA 염기서열은 유전정보를 나타내는 유전자 구간과 그렇지 않은 비부호화 DNA 구간으로 나눌 수 있다.[4] 과거에 기능을 가진 유전자였더라도 돌연변이를 통해 기능을 상실한 슈도진이 되면 비부호화 DNA가 된다.[5]
DNA는 스스로를 복제하고 유전정보를 통해 유전자 발현이 일어나게 한다. 유전자는 DNA 사슬의 특정 구간으로 실제 단백질 형성과 같은 발현에 관여하는 엑손 구간과 그렇지 않은 인트론을 포함한다.[6] DNA가 직접 유전자 발현을 실행하는 것은 아니며 실제 발현 과정은 DNA에서 전사된 전령 RNA(mRNA)가 지닌 코돈에 의해 진행된다. 코돈은 세 개의 염기서열이 묶인 유전단위로 시작 코돈과 종결 코돈 그리고 그 사이에 실제 아미노산 결합을 지시하는 코돈들로 이루어져 있다. mRNA는 리보솜에서 효소와 같은 단백질을 합성하게 한다.[7]
DNA는 1869년 스위스의 프리드리히 미셔가 처음 발견했다. 그는 세포 핵 안에서 발견한 산이라는 의미로 뉴클레인이라고 불렀다. 이후 DNA는 유전의 원인으로 오랫동안 지목되어 왔으며 1944년 오즈월드 에이버리의 형질전환 실험을 통해 DNA가 유전물질임이 확인되었고 1952년 앨프리드 허시(Alfred Hershey)와 마사 체이스의 허시-체이스 실험으로 확정되었다.[8][9] DNA의 이중나선 구조는 제임스 왓슨과 프랜시스 크릭이 1953년 네이처지에 실은 논문에서 처음으로 밝혔다. 그러나 DNA가 이중나선 구조를 가졌다는 결정적인 증거인 DNA의 X선 회절 사진은 로절린드 프랭클린이 찍은 것이었으며, 그녀와 앙숙이었던 동료 과학자 윌킨스가 프랭클린의 사전 허락 없이 회절사진을 분석하고 왓슨과 크릭에게 제공함으로써 왓슨과 크릭의 연구가 가능했기에 이후 그들은 "프랭클린의 영광을 도둑질했다"는 비판을 받았다. 한편 프랭클린은 암으로 인해 1958년에 사망하여 노벨상 후보에 오르지 못하였다.[10]
구조
편집DNA는 뉴클레오타이드 중합체 두 가닥이 서로 꼬여있는 이중나선 구조로 되어있다. DNA를 이루는 뉴클레오타이드는 디옥시리보스를 중심으로 한 쪽에는 인산염이 결합되어 있고 다른 한 쪽에는 4 종류의 핵염기 가운데 하나가 결합되어 있다. 디옥시리보스와 인산기가 중합 과정을 통해 사슬 한 가닥의 뼈대를 이루고 핵염기들이 서로 상보적인 수소 결합을 통해 염기쌍을 이루며 이중나선을 만든다.[3] 한편 이러한 DNA의 상보성은 한쪽만으로 상대편을 예측할 수 있음을 의미하게 된다.
이중나선 구조는 DNA의 기능을 수행하는데 필수적이다. 뉴클레오타이드의 핵염기는 유전정보를 저장하는데 수소 결합으로 유지되기 때문에 쉽게 풀렸다 닫힐 수 있다. 이 때문에 이중나선은 유전자 발현을 위해 일부분이 풀렸다가 닫힐 수도 있고 세포 분열 과정에서 완전히 풀리면서 복제될 수도 있다. 일부 또는 전체가 풀린 이중나선은 유전자 발현이 종료되거나 복제가 끝나면 다시 닫히게 된다. 한편 이 과정에서 일어나는 돌연변이는 진화의 원인이 된다.[11]
뉴클레오타이드
편집뉴클레오타이드는 디옥시리보스를 중심으로 한 쪽은 인산염이 다른 한 쪽은 핵염기(nucleobase)가 결합되어 있는 DNA의 단위체이다. 생체에는 여러 종류의 뉴클레오타이드가 있으며 저마다 독자적인 역할을 맡고 있다.[12] 예를 들어 아데노신은 결합된 인산염의 수에 따라 아데노신일인산, 아데노신이인산, 아데노신삼인산과 같은 형태로 존재한다. 아데노신삼인산은 인체의 모든 세포에 화학적 에너지를 전달하는 역할을 맡고 있어 "세포의 에너지 동전"이라고도 불린다.[13] 이데노신삼인산에서 인산염 하나가 분리되어 아데노신이인산이 되면서 에너지를 전달한다. DNA를 이루는 것은 이것보다 인산염 하나가 더 적은 아데노신일인산이다.
DNA를 이루는 뉴클레오타이드의 핵염기는 시토신(C), 구아닌(G), 아데닌(A), 티민(타이민)(T)의 네 종류이다. 이들 핵염기와 연결된 뉴클레오타이드는 마치 레고 블럭처럼 DNA를 이루는 기본 단위가 된다.[14] 구아닌은 시토신과 아데닌은 티민과 서로 상보적으로 결합하여 염기쌍을 이룬다. 염기의 모양과 화학구조 때문에 상보적인 두 핵염기만이 꼭 들어맞기 때문이다. 그렇기 때문에 DNA 가닥의 한쪽 염기서열만 알면 다른쪽은 자동적으로 알 수 있다. 예를 들어 한 쪽 가닥의 염기서열이 -A-C-G-T- 라면 다른 쪽 가닥의 염기서열은 -T-G-C-A- 가 된다.
아데닌(A)과 티민(T)은 두 개의 수소 결합으로 연결되고 구아닌(G)과 시토신(C)은 세 개의 수소 결합으로 연결된다.[15] 수소결합의 개수 때문에 A-T 결합은 G-C 결합보다 결합력이 약하고 상대적으로 파손되기 쉽다. 생명체가 죽으면 DNA 역시 여러 이유로 손상을 입기 시작하는데, 상대적으로 결합력이 약한 A-T 쪽이 먼저 파괴되는 경향이 있다. 살아있는 동안에도 티민은 계속적인 손상을 입어 우라실로 대체되며 이렇게 손상을 입은 DNA는 소변을 통해 배출된다.[16]
-
구아노신일인산
-
티미딘일인산
-
시티딘일인산
-
구아닌과 시토신의 상보 결합
-
아데닌과 티민의 상보 결합
대부분의 생물은 위 네 핵염기만이 DNA의 단위체이지만 바이러스의 일종인 일부 박테리오파지는 우라실도 단위체로 사용된다. 박실루스 슈브틸리스(Bacillus subtilis) 종에 속하는 박테리오파지 PBS1과 PBS2 그리고 예르시니아(Yersinia) 박테리오파지 piR1-37의 DNA는 티민이 우라실로 대체되어 있다.[17] 그러나 거의 대부분의 생물에서 우라실은 RNA의 단위체로서만 관여한다.
D디옥시리보스와 인산의 중합 형성으로 생기는 구조 때문이다. 리보스와 디옥시리보스는 모두 탄소 5개로 이루어진 오탄당으로 단원자 산소를 매개로 오각형의 구조를 이룬다. 단원자 산소에서 시계방향으로 각 탄소마다 1번에서 5번까지 번호를 붙여 위치를 나타낸다.[18]→ 3' 연결 방향성이라고 부른다.[19]역평행성과 상보성을 보인다. 이와 같이 하여 적 구조를 유지하게 된다.[15]
이중나선의 종류
편집DNA 이중나선은 대개 오른 나사 방향으로 꼬이는 B형이 일반적이긴 하지만 꼭 그것만이 유일한 구조는 아니다. 널리 알려진 유형으로는 A-DNA, B-DNA, Z-DNA가 있다. DNA 이중나선은 나선 사이에 홈이 패이게 되는데 넓게 패이는 주홈과 좁게 패이는 부홈을 구분할 수 있다. 가장 일반적인 B-DNA의 경우 한 번 감긴 나선 마다 10개의 염기쌍이 놓인다. 그런데 A-DNA는 나선의 기울기가 수직축을 기준으로 30°정도 기울어져 있어서 더 큰 폭으로 회전한다. 이 경우 나선 사이의 홈도 비슷하게 패여서 주홈과 부홈을 구분하기 힘들게 되며 나선 하나에 놓이는 염기쌍도 11개로 B형 보다 1개 더 많다. 한편 Z-DNA는 나사의 회전 방향이 B-DNA와 거울상 대칭을 보이고 나선 하나에 12개의 염기쌍이 놓이게 된다. 그 결과 Z-DNA는 B-DNA보다 길고 홀쭉하게 보이게 된다.[20]
DNA는 대부분 B형을 보이지만 매우 긴 DNA 사슬은 여러 형태의 DNA 사슬구조가 섞여 있다. 구아닌(G)과 시토신(C)이 반복하여 염기서열을 이룰 때 Z형 나선을 이루는 경향이 있으며 유전자와 인접한 Z형 나선은 유전자 발현에 영향을 미친다.[20]
환형 DNA와 초나선 DNA
편집오랫동안 DNA 이중나선은 기다란 끈 모양으로 여겨져 왔지만, 전자현미경 관찰을 통해 많은 경우 양 끝이 공유결합을 통해 고리 모양을 이루는 환형 DNA가 된다는 것을 알게 되었다. 또한 DNA 이중나선 역시 다시 한 번 꼬여서 초나선을 이룰 수 있다. DNA가 이렇게 고리 구조를 이루기 위해서는 사슬의 방향성 때문에 한쪽 끝의 3' 말단이 반대편 끝의 5'말단과 공유결합을 하는 수 밖에 없다. 이렇게 하려면 DNA 사슬 자체가 1 회 이상 더 회전하여야 한다. DNA 사슬의 나사 진행 방향과 같은 방향으로 회전하여 고리를 만든다면 나선을 더 단단히 조이는 효과가 일어나고 이를 양성 초나선이라고 한다. 반대로 DNA 사슬의 나사 진행 방향과 반대 방향으로 회전함으로 인해서 고리를 만든다면 DNA 나선을 풀어주는 효과가 나타나고 이를 음성 초나선이라고 한다. 실제 DNA는 그것의 나선 1회전 당 염기쌍 수를 유지하려는 경향이 있기 때문에 구조를 변형하여 초나선에 의한 영향에 맞선다. 예를 들어 B-DNA는 나선축이 휘어져 나선 1회 당 10개의 염기쌍 주기를 유지한다.[21]
DNA의 위상적 구조가 갖는 생물학적 기능은 아직 알려진 바가 많지 않다. 게다가 DNA 구조는 늘 일정하게 고정된 것이 아니라 풀렸다 닫히기를 반복하면서 변한다. DNA 회전효소는 초나선 현상을 완화하는 효소로, 공유결합된 말단을 풀어 고리를 끊고 너무 꼬여버린 줄을 풀어준다음 다시 연결한다.[22]
기능
편집DNA에는 생물의 유전정보가 담겨있다. 그러나 DNA의 염기서열 모두가 유전자 발현에 관여하는 것은 아니다. 실제 유전형질의 발현에 관여하는 염기서열을 유전자라고 하고 그렇지 않은 부분을 비부호화 DNA라고 한다.[4] 비부호화 DNA 가운데에는 예전에는 유전자로 기능하였으나 돌연변이 등으로 더 이상 기능하지 않는 슈도진이 포함되어 있다.[5]
유전자가 직접 생물을 이루는 물질을 만들지는 않는다. 유전자에는 어떤 것을 어떻게 만들 지에 대한 정보만이 담겨있다. 따라서 DNA는 생물의 설계도를 담고 있는 청사진이라기 보다는 마치 요리책처럼 해야할 작업을 순서대로 적은 레시피에 가깝다.[23] DNA의 정보는 여러 단계를 거쳐 가공되고 처리되어 최종 결과물 생성에 관여하게 된다.
따라서 DNA의 기능은 다음의 두 가지로 정리할 수 있다.[24]
- DNA는 스스로를 복제한다.
- DNA는 유전정보를 보관한다.
유전자 발현
편집유전자는 DNA의 일정 구간에 걸쳐 있는 염기 서열이다. 유전자에는 실제 유전정보가 담겨있는 엑손 구간과 발현에 관여하지 않는 인트론 구간이 있다. 엑손 구간의 시작은 촉진유전자(Promoter, 프로모터)에서 시작한다. 촉진유전자는 DNA 나선 두 가닥 중 어느쪽이든 있을 수 있다.
DNA에 있는 유전자는 정보만을 지정하고 실제 단백질의 형성과 같은 일은 리보솜과 같이 세포 핵 밖에서 일어나기 때문에 둘 사이의 정보 전달이 필요하다. 이 정보 전달은 전령 RNA(messenger RNA, mRNA)라고 불리는 "전령"이 담당한다. 촉진유전자는 바로 이 전령이 생성되는 시작점으로 어디서 시작해야 하는지 DNA의 두 가닥 가운데 어느 쪽을 이용해야 하는지 어느 방향으로 읽어야 하는지와 같은 정보를 지정한다. 촉진유전자의 염기 서열 자체가 한 방향으로만 의미를 지니기 때문에 거꾸로 읽히는 일은 일어나지 않는다.
유전 정보를 전달하는 전령인 mRNA는 RNA 중합효소에 의해 DNA에서 전사되어 형성된다. RNA 중합효소는 전사 시작 위치인 촉진유전자에 결합하는데 촉진유전자에서 멀리 떨어진 곳에 RNA 중합효소가 정확히 "착륙"할 수 있도록 유도하는 일단의 염기서열이 있다. RNA 중합효소는 이 유도 표지를 따라 접근하여 정확한 시작위치에 결합한 다음 DNA 사슬을 풀고 DNA와 상보적으로 형성되는 RNA 사슬을 엮는다. DNA와 달리 RNA는 아데닌의 상보적 핵염기로 우라실(U)이 사용된다. RNA 중합효소가 지나가면 DNA는 스스로 다시 감긴다. RNA 중합효소는 계속하여 mRNA를 결합하다가 종결 위치를 만나면 전사를 멈춘다. 종결 메커니즘은 복잡하고 한 종류 이상이다.[25]
유전자가 전사된 mRNA는 염기서열 세 개가 모여 하나의 코돈을 이루는데 실제 의미를 지니는 것은 이 코돈이다. 코돈은 시작 코돈, 아미노산 지정 코돈, 종결코돈으로 이루어진다. 예를 들어 우라실 셋이 모인 코돈 UUU는 아미노산의 하나인 페닐알라닌을 지정한다. 네개의 염기가 짝을 이루어 하나의 코돈을 이루는 경우의 수는 이므로 모두 64가지의 코돈이 있지만, 코돈이 다르더라도 동일한 아미노산이 지정되는 경우도 있어 실제 지정되는 아미노산은 모두 20개이다. 또한 코돈에는 한 개의 시작 코돈과 세 개의 종결 코돈이 있다.[26]
진핵생물의 경우 전사는 두 단계를 거친다. DNA에서 곧바로 전사된 1차 전사체는 엑손 부분과 인트론 부분이 함께 전사되며 있다. 최종 형성되는 mRNA는 이 가운데 인트론 부분을 잘라내 버린다. 대개의 경우 인트론 전사체 RNA의 절단은 전사가 종결된 뒤 핵 안에서 이루어지고, 핵 안에는 잘려진 다양한 크기의 RNA 분자가 남게 된다. RNA 절단에 관여하는 소자는 스프라이소좀으로 유전자 서열 자체에 어느 부분이 절단될 것인지를 지정하는 염기서열이 따로 있어서 매우 정교하게 잘라내어 접합한다. 잘려나가는 부위는 때로 전체 전사체의 90%에 달하는 경우도 있다.[27]
이렇게 형성된 mRNA는 리보솜으로 옮겨가 번역된다. 리보솜은 세포내의 "공장"으로 실제 컨베이어 벨트에 자리한 조립공처럼 일한다. mRNA에는 리보솜 결합 부위라는 번역 개시 신호가 있어 어디서부터 아미노산 결합을 시작할 지 지시한다.[28] 리보솜은 mRNA를 "읽어"들이고 그에 맞는 아미노산을 달고 있는 운반 RNA(transfer RNA, tRNA)를 받아들인 후 아미노산은 펩티드 결합에 사용하고 tRNA는 방출한 다음 다음 코돈을 읽는다. 이런 과정을 종결 코돈이 있을 때까지 반복한다. 비유하자면 mRNA는 작업지시서, tRNA는 운반도구, tRNA에 결합한 아미노산은 재료가 되는 셈이다.[29]
tRNA는 독특한 접합이 있는 RNA로 한쪽 끝엔 mRNA와 상보적인 안티코돈이 있고 다른 한쪽엔 특정 아미노산과 결합할 수 있는 구간을 지니고 있다.[30] DNA에는 tRNA를 만들 수 있는 전사 구간이 별도로 존재하며 이 역시 유전자의 하나이다. tRNA는 세포 내에서 자신과 짝을 이루는 아미노산과 결합해 있다가 근처의 리보솜에 끌려들어가 아미노산 합성에 참여하고 방출된 뒤에는 다시 아미노산과 결합한다. 이 과정은 세포 내 물질의 밀도에 의존한다.
유전자 발현에서 단백질 합성의 재료가 되는 아미노산은 대부분 체내에서 합성되어 있다가 mRNA가 전달한 정보에 따라 단백질로 결합한다. 하지만 대부분의 동물은 자신이 필요로 하는 아미노산 전체를 모두 체내에서 생성하지는 못한다. 이때문에 반드시 음식을 통해 섭취해야 하는 필수 아미노산이 있다. 사람의 경우 20개의 아미노산 가운데 트립토판, 메티오닌, 발린, 트레오닌, 페닐알라닌, 류신, 이소류신, 리신의 8 개는 체내에서 합성하지 못한다. 이들 8개의 필수 아미노산은 우유, 계란, 고기 등에 풍부하므로 육식을 할 경우 큰 문제가 되지 않지만 채식주의자의 경우엔 콩이나 두부, 기타 여러 곡물 등을 혼합하여 필수 아미노산이 부족해 지지 않도록 식단에 주의하여야 한다.[31]
결국 DNA에서 전사되어 형성된 mRNA와 DNA의 다른 구간에서 형성된 tRNA가 재료인 아미노산을 이용하여 리보솜에서 아미노산 사슬을 만들어 내는 것이 유전자 발현의 핵심이다.[29] 이렇게 만들어진 아미노산 사슬은 단백질 접힘과정을 거쳐 특정한 기능을 갖는 단백질이 된다.[32] 대표적인 단백질로는 효소가 있다. 효소는 체내의 생화학 반응을 매개하는 촉매로서 3차원 구조가 기능에 매우 중요하게 작용한다. 효소가 작용하는 부위를 효소의 활성자리라고 하는데 효소의 구조가 변하면 이 활성 자리 역시 바뀌어 다른 기능을 수행하게 된다.[33]
돌연변이
편집유전자의 염기서열 어느 한 곳에 돌연변이가 일어났다고 가정하면 그 돌연변이의 결과 코돈이 바뀌게 되고 그에 따라 최종 형성되는 아미노산 역시 바뀌게 된다. 그 결과가 치명적이지 않다면 대개의 아미노산 변형은 자식에게 유전된다.[34] 돌연변이는 자연적으로 계속하여 생성되며 방사선을 쬐거나 화학물질을 이용하여 인공적으로 유도할 수도 있다.[35] 생물은 DNA 수선 메커니즘을 가지고 있어서 문제가 되는 돌연변이를 계속 수정한다.[36] 그러나 모든 돌연변이를 다 수정할 수 없기 때문에 결국 유전정보의 변이가 발생한다. DNA에는 유난히 돌연변이가 자주 일어나는 구간이 있으며 메틸화된 핵염기를 치환하면서 오류를 보인다.[37] 유전 정보를 담지 않는 비부호 염기서열도 동일하게 이러한 돌연변이를 겪을 수 있는데, 미토콘드리아 DNA의 조절 부위는 별다른 유전자 발현을 하지 않으면서 돌연변이가 빈번하여 집단의 친연관계를 추적하는 도구로 이용된다.[38]
이런 과정을 거쳐 유전자의 동일한 위치를 놓고 원래의 유전정보 A와 변형된 유전정보 A'가 서로 경쟁하게 된다. 즉 어느 유전자가 후손에게서 더 많이 발현될 수 있는 가 하는 대립형질 발현빈도 문제가 생기게 되는 것이다.[39] 멘델의 유전법칙은 이렇게 발생한 대립형질에 우열 관계가 있음을 보여준다.[40]
한편, 환경이 어느 한 쪽 형질에 유리할 경우 점차 유리한 형질만이 살아남게 되어 생물 집단 전체의 유전형질에 변화를 가져오게 된다. 따라서 진화의 기본 조건은 계속하여 발생하는 돌연변이라고 할 수 있다.[41]
복제
편집DNA는 스스로를 복제한다.[24] 생물은 생장과 발달을 포함한 생애 전 단계에서 끊임 없이 세포분열을 필요로 한다. 세포가 분열될 때에는 그 세포가 갖고 있는 유전 정보 역시 빠짐 없이 나누어져야 한다. 이 과정에서 DNA 복제가 일어난다.[42]
DNA 사슬이 어떻게 풀리고 복제되는 지에 대해서는 여러 가지 가능성이 있지만 1957년 메튜 메셀슨과 프랭클린 스탈의 실험을 통해 두 가닥이 풀린 후 각 가닥마다 새로운 상보적 염기서열이 형성되어 두 개의 DNA가 형성되는 반보존적 복제가 이루어짐을 확인하였다. 즉, 복제된 DNA 두 개는 각자 원래의 DNA 가닥 가운데 하나를 포함하고 있게 된다.[43]
DNA 회전효소가 DNA 이중나선이 풀리면서 생기는 과도한 꼬임을 방지하기 위해 이중나선에 결합한다. 그 후 헬리카아제가 실제 이중나선의 결합을 푼다. 이중나선이 풀리면 DNA 중합효소가 복제를 시작한다. 하지만 DNA 복제에는 RNA로 이루어진 프라이머가 필요하다. DNA 복제를 진행하는 DNA 중합효소가 DNA의 시작점부터 직접 복제를 시작할 수 없기 때문이다. 효소의 하나인 프리마아제가 열려진 DNA의 한쪽 가닥에 프라이머를 결합시킨 뒤 떨어져 나가면 그 자리에 DNA 중합효소가 결합하여 새로운 이중나선을 만들기 시작한다.[44]
한편, 새로운 DNA 이중나선은 서로 반대되는 방향으로 생성된다. 원래의 DNA 나선에 DNA 회전효소가 지나가며 지퍼를 열듯이 나선을 분리하면 이렇게 열리는 방향과 같이 진행되는 선도 사슬(Leading strand)는 진행 방향을 따라만 가면 되기 때문에 아무런 문제가 없다. 그러나 반대 방향으로 진행되는 지연 사슬(Lagging strand)는 그렇게 할 수가 없다. 원래의 DNA 이중나선이 풀리고 충분한 길이의 새로운 염기서열이 확보 되어야 계속해서 복제를 할 수 있기 때문이다. 이 때문에 프리마아제가 헬리카아제의 뒤에 연결되어 임시로 토막토막 끊어지는 프리미어 RNA를 만들고 뒤에 거꾸로 향하는 DNA 중합효소가 절편을 만들며 잇는다. 이를 발견자의 이름을 따 오카자키 절편이라 한다.[45]
이러한 복제 과정을 거치면 지연 사슬의 끝은 더 이상 프리미어를 놓을 자리가 없게 되고 그 결과 DNA 사슬의 말단 일부는 복제되지 않은 채 남는다.[46] 이 때문에 복제가 거듭되면 염색체의 끝부분인 텔로미어가 점점 짧아지게 된다. 텔로미어가 짧아지는 현상은 노화의 원인으로 지목되고 있다.[47]
한편, 유성생식을 하는 생물은 자식 세대의 재생산을 위해 감수분열을 한다. 정자와 난자같은 생식세포는 유전자 재조합을 거치는 감수분열을 통해 성체가 가지고 있는 원래 유전 정보의 절반을 갖게 된다.[48] 진핵생물의 세포에는 DNA와 핵 이외에도 여러 세포소기관이 있는데 미토콘드리아와 같은 대개의 세포소기관은 난자에서 기원한 것이다.[49] 관행적으로 생식세포의 유전체를 n, 수정 이후의 유전 정보를 2n으로 표기하여 동수의 유전정보가 암수에게서 온다고 이해하고 있었으나 적어도 포유류에서는 그렇지 않다는 것이 확인되었다. 정자의 염색체만을 두배로 하여 2n이 되도록 하거나 난자의 염색체만을 두배로 하여 발생을 유도한 실험 모두에서 정상적인 발생이 일어나지 않았기 때문이다. 따라서 현재로서는 무엇인지 정확하진 않지만 일부 유전자는 반드시 정자를 통해 와야하고 또 다른 일부 유전자는 반드시 난자를 통해 유전되어야 한다고 결론지을 수 있다.[49]
게놈과 염색체
편집DNA는 염기서열의 형태로 유전정보를 담고 있다. 한 생물이 지니는 DNA 염기서열 전체를 게놈이라고 한다.[50] 한편, 세포 분열 과정에서 DNA 사슬은 염색체를 형성한다.
게놈
편집한 생물이 지니는 DNA 염기서열 전체를 게놈이라고 한다. 게놈은 유전자(Gene)와 염색체(chromosome)를 합성하여 명명한 낱말로 1920년 함부르크 대학교의 식물학 교수 한스 빙클러가 제안하여 널리 사용되고 있다.[51] 한국어 번역어로는 유전체(遺傳體)가 쓰인다. 게놈의 길이는 생물마다 천차만별이다. 가장 먼저 게놈이 해독된 예쁜꼬마선충의 경우 게놈의 크기는 1억 쌍의 염기서열 정도이지만, 2003년 인간 게놈 프로젝트이 완료된 인간 게놈의 경우 DNA 한 가닥당 3,234.83 Mb(메가베이스)의 염기서열로 이루어져 있어 두 가닥을 합친 총 염기서열 양은 6,469.66 Mb이 된다.[52] 각각의 세포마다 들어있는 게놈의 길이는 약 1.8 m에 달한다.[53] 그러나 사람의 세포 핵의 크기는 5 μm에 불과하기 때문에[54] DNA는 매우 가늘고 긴 사슬이라고 생각할 수 있다. 식물의 경우 매우 거대한 게놈을 갖기도 한다. 백합의 게놈은 인간보다 18배나 더 크다.[55]
게놈이 해독되었다고 모든 유전자의 위치와 기능이 밝혀진 것은 아니다. 유전자의 기능에 대한 연구는 아직도 밝혀지지 않은 부분이 많다.[56]
염색체
편집① 염색분체 ② 동원체
③ p 팔 ④ q 팔
DNA는 평소 세포 핵 내부에서 단백질과 결합하여 염색질을 이룬다. 염색질은 매우 가늘고 긴 실과 같으므로 전자현미경을 통해서나 관찰이 가능하다. 그러나 세포분열 과정에선 염색체 단위로 뭉치게 되어 광학현미경으로 쉽게 관찰이 가능하다.[57] 염색체는 생물 종마다 수와 크기가 다르다. 인간의 경우 22 쌍의 상염색체와 1쌍의 성염색체가 있다. 상염색체는 1번 염색체, 2번 염색체와 같이 번호로 불리고 성염색체는 x 염색체와 y 염색체 등으로 불린다.[58]
성염색체는 동물마다 달라 어류는 ZO 성결정 체계를 따른다. 인간을 포함한 포유류의 성결정은 XX인 경우가 암, XY인 경우가 수로 수컷이형을 보이지만, ZO 성결정 체계는 Z 유전자 하나만 있을 경우 암, ZZ인 경우 수로 암컷이형을 보인다.[59] XY 성결정 체계와 달리 ZO 성결정 체계는 암수의 유전적 구별이 보다 유연하기 때문에 자연적인 성전환이 일어나기도 한다. 어류의 경우 400여 종에서 생애 주기에 따라 성전환이 일어나는 것으로 알려져 있다. 예를 들어 감성돔은 모두 수컷으로 태어나지만 2~3년이 지나면 암컷으로 성전환이 이루어지기 시작하여 5~6년생이 되면 모두 암컷이 된다.[60] 한편 조류의 경우엔 ZW 성결정 체계를 따른다.[61]
염색체는 DNA 사슬이 염색질을 단위로 뭉친 것이다. DNA 사슬은 단백질의 일종인 히스톤을 실패삼아 감긴다. 히스톤은 모두 다섯 종류로 되어 있으며 이 가운데 히스톤 H2A, H2B, H3, H4 가 각 한 쌍씩 8개가 팔량체를 이뤄 실제 실패와 비슷한 구조를 만든다.[62]. 히스톤 실패에 감긴 DNA를 뉴클레오좀이라 하는데 이것이 DNA 저장의 가장 기본적인 단위가 된다. 146개의 염기쌍이 히스톤 실패를 1.65번 감는다.[63] 한편 실패를 이루지 않는 히스톤 H1은 실패 밖에서 DNA를 고정하는 역할을 한다.[62]
뉴클레오좀은 다시 꼬여서 더 두꺼운 코일을 형성하는데 나선 1회전에 6 개의 뉴클레오좀이 감긴다. 이렇게 만들어진 코일은 또다시 접혀져 루프를 만들고 이렇게 여러차례 겹쳐 만들어진 루프가 염색체를 이룬다.[62]
염색체는 세포분열 과정에서 두 개의 염색분체가 동원체를 중심으로 묶여 있는 모습이 된다. 이 염색분체들은 세포분열 말기에 각자 다른 딸 세포의 극으로 끌려가 새로운 세포 핵을 형성하게 된다.[64] 염색체는 동원체를 중심으로 긴 팔과 짧은 팔이 구분되데 긴 쪽을 q 팔, 짧은 쪽을 p 팔이라고 한다.[65] q와 p는 염색체 위에서 유전자의 위치를 정할 때 기준이 된다. 동원체에서 가까운 쪽에서부터 q1 또는 p1과 같이 번호를 붙이며 멀수록 p20 또는 q40과 같이 큰 번호가 부여된다. 1p1은 1번 염색체의 짧은 팔에서 동심원에 가장 가까운 위치를 뜻하게 된다.[66] 예를 들어 ABL2 효소 합성을 지시하는 ABL2 유전자는 1번 염색체의 1q25.2 에 위치해 있다.[67] 아래의 다이어그램에서 오른쪽 중간쯤에 그 위치가 표시되어 있다.
염색체 위의 유전자 위치를 밝혀내는 지도 작성은 매우 길고 복잡한 DNA 염기서열의 해독을 필요로 한다. 거대한 염기서열 전체를 한 번에 보기는 불가능하기 때문에 실제 지도 작성은 적당한 크기로 잘린 DNA 절편을 이용한다. 자잘하게 잘린 절편들은 겔 전기 영동법과 같은 방법으로 분리되어 염기서열이 해독된다. 동일한 정보를 갖는 여러 가닥의 DNA를 사용하면 직소 퍼즐을 맞추듯이 서도 들어 맞는 절편들을 차례로 이어 붙일 수 있다. 하나의 절편은 상보적 결합을 이용해 대량으로 복제하여 유전자 라이브러리를 만들 수 있고 이를 이용하면 해독의 시간과 비용을 절약할 수 있다. 1983년 중합효소 연쇄반응(polymerase chain reaction, PCR)이 고안되어 소량의 시료로부터 라이브러리를 대량 생산할 수 있게 되었다.[68] 21세기에 들어서는 방사성 동위원소를 삽입한 핵염기가 분리될 때 발생하는 광자를 직접 검출하는 방식이 개발되어 더욱 빠른 해독이 가능해졌다.[69]
세포소기관의 독립적 DNA
편집미토콘드리아와 엽록체는 독자적인 DNA를 갖는다. 사람의 미토콘드리아 DNA에는 2 개의 RNA 유전자, 22 개의 tRNA 유전자, 13 개의 단백질 합성 유전자가 있다.[70] 린 마굴리스는 진화 과정의 어느 시점에서 별개의 생물인 미토콘드리아와 엽록체가 진핵 생물의 조상과 공생을 이루었다는 가설을 제시하였다.[71] 엽록체 DNA는 보통 120~150여개의 유전자가 배열되어 있으며 염기서열은 약 150 kb 내외이다.[72]
발견의 역사
편집핵산과 염색체의 발견
편집DNA는 1869년 스위스의 프리드리히 미셔가 처음 발견했다. 그는 세포 핵 안에서 발견한 산이라는 의미로 뉴클레인이라고 불렀다.[73] 미셔가 핵산을 발견한 직후 세포 핵에서 막대모양의 구조를 매우 진하게 염색시키는 방법이 개발되었다. 1879년 발터 플레밍은 핵에서 염색되는 물질을 설명하기 위해 염색질이라는 이름을 붙였으며 세포 분열 과정에서 뭉쳐저 염색체가 된다는 것도 발견하였다. 얼마 지나지 않아 미셔의 뉴클레인과 플레밍의 염색질은 동일한 물질임이 확인되었다. 이 시기에 이미 많은 학자들이 염색질이 유전에 관여한다고 추측하였고 많은 실험들이 이루어졌다.[74]
유전자의 발견
편집1910년 토머스 헌트 모건은 초파리를 대상으로 한 연구를 통해 염색체와 유전의 관계를 입증하였다. 그는 애초에 초파리의 짧은 세대 주기를 이용해 진화를 재현할 생각으로 2년간 실험했지만 실패하였다. 초파리를 빛이 들지 않는 암실에서 70세대 이상 사육하였으나 초파리의 눈이 퇴화한다거나 하는 현상은 일어나지 않은 것이다. 그대신 초파리의 눈이 하얗게 변하는 돌연변이가 발견되었다. 그는 정상인 붉은눈 초파리와 돌연변이 흰눈 초파리를 교배하여 2세대에서 모두 붉은눈이 발현되는 것을 확인한 다음 3세대에서는 붉은눈과 흰눈이 섞여 나오는 것을 관찰하였다. 여기까지는 멘델의 유전법칙에 따른 우성/열성 유전형질 발현을 다시 확인한 셈이다. 그런데 흰눈 초파리가 모두 수컷이었다. 그는 초파리의 눈을 희게 만든 열성인자가 초파리의 성염색체에 놓여있기 때문이라고 결론지었다. 이후 모건은 초파리의 염색체 실험을 계속하여 여러 유전자가 염색체의 특정한 위치에 일렬로 배열되어 있음을 확인하고 유전자 지도를 작성하였다.[75]
염색체 위에 놓인 유전자가 유전형질을 결정한다는 사실이 확인되자 학자들은 그것이 어떤 방식으로 발현되는 지를 놓고 가설을 세웠다. 영국의 아치볼드 게로드는 하나의 유전자가 하나의 효소를 지정한다는 1유전자 1효소설을 주장하였고, 1941년 조지 비들과 E. L. 테이텀이 붉은빵곰팡이를 이용한 실험을 통해 이를 입증하였다. 이들은 곰팡이에 엑스선을 쬐어 특정한 아미노산을 형성하지 못하는 돌연변이를 얻었다. 이렇게 하여 발생한 점돌연변이 때문에 돌연변이 곰팡이는 다른 기능이 정상이더라도 합성하지 못하는 아미노산을 외부에서 공급하지 않으면 효소를 만들지 못했다.[76]
DNA의 역할 확인
편집프레더릭 그리피스는 1928년 그리피스 실험을 통해 형질전환을 발견하였다. 폐렴쌍구균은 면역반응에 걸려 병을 유발하지 못하는 R형과 폐렴을 유발하는 S형이 있는데, S형이라 할지라도 열을 가해 균을 죽이면 폐렴이 발생하지 않는다. 그런데 죽은 S형 균을 R형 균에 섞어 넣었더니 R형이 모두 S형으로 전환된 것이다. 그리피스는 S형의 어떤 요소가 R형에게 전달되어 형질변환이 일어났다고 결론지었지만 그 요소가 무엇인지 특정하지는 못했다.[77] 1944년 오즈월드 에이버리는 그리피스의 실험을 훨씬 정교하게 통제하여 열처리한 S형 균을 탄수화물, 단백질, DNA로 구분하여 R형 균에 투입하였고, 그 결과 DNA가 형질변환의 원인임을 밝혀내었다.[78]
에이버리의 실험 이후에도 유전 정보를 전달하는 물질이 무엇인지를 놓고 논쟁이 계속되었다. DNA는 처음부터 계속하여 강력한 후보였으나 단백질 역시 만만찮은 후보였다. DNA와 단백질 가운데 어떤것이 유전 요인인지를 확실히 구분할 필요가 있었다. 1952년 알프레드 허시와 마사 체이스가 더욱 정교한 통제 조건으로 허시-체이스 실험을 실시하였다. 허시와 체이스는 박테리오파지의 단백질과 DNA에 방사성 동위원소 표식을 달아 대장균에 주입한 후 무엇이 유전에 관여하는 지를 관찰하고 그것이 DNA임을 확정하였다.[79][80]
DNA의 구조 발견
편집DNA의 역할에 대한 논란과는 별개로 DNA의 구조 역시 오랫동안 여러 가설만이 제시될 뿐이었다. 1935년 러시아 출신의 미국 생화학자 피버스 레빈은 뉴클레오타이드가 인산을 통해 서로 연결된다는 것을 확인하였다. 그러나 당시 과학자들은 고분자 화합물인 DNA의 크기를 제대로 알 수 없었고, 실제로는 핵염기의 구성비 역시 제각각일 수 밖에 없다는 것도 알지 못했다. 레빈은 DNA를 이루는 핵염기 4종이 모두 같은 비율로 존재할 것이라고 가정하고 이들이 짝을 이루는 사각형 구조를 가설로 제시하여 많은 호응을 얻었다. 그러나 실제 DNA의 핵염기 비율은 4종 모두가 똑같지는 않기 때문에 레빈의 가설은 근본부터 잘못된 것이었다.[81]
오스트리아 출신의 미국 생화학자 어윈 샤가프는 DNA의 핵염기가 모두 동일한 양을 지니는 것은 아니지만 아데닌과 티민, 구아닌과 시토신은 언제나 동률을 보인다는 것을 발견했다. 샤가프 스스로는 이 발견에서 더 나아가지 못했지만, DNA 핵염기의 상보성에 대한 중요한 단서를 제공했다.[82]
윌리엄 로런스 브래그가 이끄는 캐임브리지 대학교 캐번디시 연구소는 1948년부터 X선 회절을 이용해 DNA의 구조를 직접 관찰하고자 하였다. X선도 일종의 빛이기 때문에 굴절, 반사와 같은 현상이 일어나며 회절은 작은 물질을 지나가는 빛이 물질의 그림자 영역까지 애돌아 나가는 현상이다. 결정의 모양에 따라 회절 모양도 달라지게 되므로 역으로 이용하면 물질의 구조를 파악할 수 있다. X선을 결정에 조사하면 브래그 법칙을 만족하는 방향으로만 X선이 회절되어 결정구조가 반영된 패턴을 남긴다.[83] 1952년 로절린드 프랭클린은 이후 DNA의 구조 파악에 결정적 영향을 미친 사진 51을 촬영하였다.[84]
프랭클린의 사진 51은 프랜시스 크릭을 거쳐 제임스 왓슨에게 전달되었고 둘은 사진을 보고 DNA가 이중나선을 이룬다는 것을 확신하였다. 사진 51은 DNA의 구조가 이중 나선으로 되어있다는 것을 보여주는 결정적인 데이터로서[85] 1953년 왓슨과 크릭은 《네이처》지에 사진 51과 함께 이중나선 구조를 설명한 논문을 발표하였다.[86] 둘이 발표한 내용은 오늘날 익히 알려진 것과 같이 핵염기들이 A-T, G-C의 상보적 결합을 이루며 두 가닥의 사슬이 서로 꼬여 이중나선을 만든다는 것이었다.
복제 메커니즘의 발견
편집DNA는 구조가 규명되자 마자 그것이 스스로 복제할 수 있는 물질임을 암시하였다. 핵염기는 오직 하나의 상보적 짝만을 가지고 있기 때문에 DNA 사슬의 뼈대를 이루는 두 가닥이 분리되면 곧바로 새로운 이중나선을 구성할 수 있게 되기 때문이다. 아서 콘버그는 이러한 DNA의 복제가 효소에 의해 통제될 것이라고 추측하였고 1953년 DNA 중합효소를 발견하였다.[87]
DNA 사슬 두 가닥은 서로 반대 방향으로 복제된다. DNA 이중나선이 풀리는 방향으로 진행되는 선도 진행과 반대 방향으로 진행되는 지연 진행이 있다. 선도 진행이 연속적인 복제 과정을 거치는 것과 달리 지연진행은 DNA 이중나선의 물리적 특징 때문에 간헐적으로 이루어질 수 밖에 없다. 1968년 부부였던 오카자키 레이지, 오카자키 츠네코를 비롯한 일본의 과학자들은 이 과정에서 지연 진행되는 DNA 사슬이 일정한 크기의 절편 단위로 복제되는 것을 발견하였다. 오카자키 절편은 DNA 복제 과정을 이해하는 필수적인 개념이다.[88]
관련 주제
편집유전자 가위
편집1970년 존스 홉킨스 의과대학의 해밀턴 O. 스미스는 DNA의 특정 부위를 절단하는 제한 효소를 발견하였다.[89] 그가 발견한 제한 효소는 훗날 HindII라고 불리게 되었는데 DNA 염기서열에서 GTYRAC 구간을 찾아내 절단한다. Y는 T또는 C, R은 A또는 G가 될 수 있다. 이 효소는 1세대 유전자 가위가 되어 분자생물학 연구에 큰 공헌을 하였다. 이후 유전자 가위로 사용될 수 있는 여러 효소들이 발견되었다.[90] 오늘날에는 보다 정교한 작업이 가능한 크리스퍼가 유전자 가위로 쓰인다.[91]
유전자 가위로 DNA의 원하는 부분을 절단하면 그것을 대장균과 같은 세균의 DNA에 주입하여 대량으로 복제시킬 수 있다. 이렇게 원하는 유전자를 대량으로 복제하는 기술을 클로닝이라고 한다. 클로닝은 DNA 감식, 유전자 편집 등 여러 용도에 두루 활용된다.[92]
유전자 편집
편집유전자 가위와 클로닝 기술은 유전자 변형 생물을 만들 수 있는 기반이 되었다. 곡물이나 구근 식물은 농업의 주요 품종으로 여러 이유에서 유전자 변형이 연구되었으며 2002년 말 16개국에서 유채, 옥수수, 감자 등 15작물 68품종이 재배되고 있다. 유전자 변형 생물의 안전성 문제는 뜨거운 논쟁거리 가운데 하나이다.[93]
한편 유전자 편집은 식물 뿐만 아니라 동물도 적용 가능하다. 실험 동물에 특정한 유전형질을 발현시키기 위해 유전자 편집이 사용되기도 한다. 한편 2018년 중국에서는 인간을 대상으로 한 유전자 편집이 시도되어 큰 파장을 불러일으켰다.[94]
줄기 세포
편집DNA 염기서열에 있는 수 많은 유전자들이 발생의 어느 시점에서 발현하고 어느 시점에서 분화되어 고정되는 가 하는 주제는 발생유전학의 중요 관심사이다. 다세포 생물은 발생과 발달 과정에서 일정 시기를 지나면 세포 마다 발현될 특징이 결정된다. 피부에선 피부 세포만이 발현되고 간에선 간 세포만이 발현되어야 정상적인 활동을 유지할 수 있기 때문이다. 한번 분화가 결정된 세포는 때어내어 다른 곳에 이식하여도 결정된 대로 발달한다.[95] 줄기 세포는 아직 그 역할이 결정되지 않아 무엇으로든 분화할 수 있는 상태의 세포이다. 배아의 발생단계에서 미분화한 배아줄기세포와 성체가 되었지만 일부 계속해서 남아있는 성체줄기세포가 있다. 배아줄기세포는 미분화한 배아의 세포에서, 성체줄기세포는 혈액, 골수 등에서 얻는다.[96] 줄기세포는 각종 질병 치료를 위한 목적으로 연구되고 있지만 현재로서는 미분화한 줄기세포를 특정 방향으로 분화시키는 메커니즘을 알지 못한다.
2005년 대한민국에서는 황우석 사건으로 큰 관심을 끌기도 하였다. 황우석은 복제된 배반포에서 배아줄기세포를 획득하였다는 논문을 발표하였으나 실험이 조작되었다는 것이 폭로되어 논문이 철회되었다.[97]
DNA 감식
편집DNA는 매우 큰 정보량을 갖고 있으며 개인 마다 서로 다른 특징을 가지고 있어 DNA를 통해 신원을 특정할 수 있다. DNA 감식에는 보통 STR 분석이 쓰이는데 특정 염기서열의 짧은 반복구간이 개인마다 다른 점을 이용한다.[98] 유전자 감식은 각종 사건 사고의 신원확인, 실종자 확인과 같은 수사에 이용되며[99] 전쟁이나 학살과 같은 오래된 역사적 사건의 유해 감식에도 쓰인다.[100]
DNA 감식은 범죄의 증거로도 채택된다. 감식의 결과 동일인으로 판정되면 충분히 해당 개인을 특정한 것으로 여겨진다. 대한민국에서는 유죄 확정된 범죄자의 DNA 시료를 채취하여 등록하고 있다.[101]
유전성 질환
편집DNA에서 일어나는 돌연변이가 원인이 되어 발현하는 질병을 유전성 질환이라고 한다. 유전성 질환은 자식 세대에 유전되는데 우성/열성에 따라 발현이 되지 않고 유전 인자만 가지고 있는 경우도 있다.[102] 널리 알려진 유전성 질환으로는 백색증, 혈우병, 겸형 적혈구 빈혈증, 샤르코 마리 투스 질환과 같은 것들이 있다.
같이 보기
편집각주
편집- ↑ Malacinski 2004, 35-36쪽
- ↑ 박찬배, 미토콘드리아 유전체의 변이와 인간질병, 그리고 노화, 분자생물학뉴스, 2011년 2월
- ↑ 가 나 Pulves 2006, 209쪽
- ↑ 가 나 ‘쓰레기 DNA’가 질병 치료의 열쇠?, The Sciencetimes, 2019년 3월 3일
- ↑ 가 나 Vanin EF (1985). “Processed pseudogenes: characteristics and evolution”. 《Annual Review of Genetics》 19: 253–72. doi:10.1146/annurev.ge.19.120185.001345. ISSN 0066-4197. PMID 3909943.
- ↑ Pulves 2006, 276-277쪽
- ↑ 호아글랜드 2001, 110-121쪽
- ↑ Avery O; MacLeod C; McCarty M (1944). “Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Inductions of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III”. 《J Exp Med》 79 (2): 137–158. doi:10.1084/jem.79.2.137.
- ↑ Hershey A; Chase M (1952). “Independent functions of viral protein and nucleic acid in growth of bacteriophage” (PDF). 《J Gen Physiol》 36 (1): 39–56. doi:10.1085/jgp.36.1.39. PMID 12981234.
- ↑ 최성우 (2015). “노벨상 놓친 비운의 여성과학자”. 《Sciencetimes》.
- ↑ Pulves 2006, 210쪽
- ↑ Malacinski 2004, 22-25쪽
- ↑ 호아글랜드 2001, 46-47쪽
- ↑ 이스라엘 로젠필드 글, 보린 반 룬 그림, 이일권 역, 《DNA》, 이두 아이콘총서 Vol 8, 1997년, ISBN 89-502-0030-9, 30-31쪽
- ↑ 가 나 Malacinski 2004, 37쪽
- ↑ 스반테 페보, 김명주 역, 《잃어버린 게놈을 찾아서 - 네안데르탈인에서 데니소바인까지》, 부키, 2015년, ISBN 978-89-6051-512-3, 20-21쪽
- ↑ Kiljunen S, Hakala K, Pinta E, Huttunen S, Pluta P, Gador A, Lönnberg H, Skurnik M (December 2005). “Yersiniophage phiR1-37 is a tailed bacteriophage having a 270 kb DNA genome with thymidine replaced by deoxyuridine”. 《Microbiology》 151 (Pt 12): 4093–102. doi:10.1099/mic.0.28265-0. PMID 16339954.
- ↑ 이스라엘 로젠필드 글, 보린 반 룬 그림, 이일권 역, 《DNA》, 이두 아이콘총서 Vol 8, 1997년, ISBN 89-502-0030-9, 33쪽
- ↑ 최호형, 《미생물학》, 아카데미서적, 2004년, ISBN 978-89-7616-292-2, 311쪽
- ↑ 가 나 Malacinski 2004, 38-39쪽
- ↑ Malacinski 2004, 40-41쪽
- ↑ 커버스토리: 토포아이소머라아제 기능을 차단하는 항암제, 네이처하이라이트, 2007년7월12일
- ↑ 호아글랜드 2001, 82쪽
- ↑ 가 나 이은희, 《하리하라의 바이오 사이언스 - 세상에서 가장 흥미로운 쇼 유전의 비밀, 유전과 생명공학》, 살림FRIENDS, 2009년, ISBN 978-89-5221-055-5, 181쪽
- ↑ Pulves 2006, 228-230쪽
- ↑ Pulves 2006, 230쪽
- ↑ Malacinski 2004, 159-160쪽
- ↑ 전문진, 《현대의 생물공학과 생물산업》, 아카데미서적, 2003년, ISBN 978-89-7616-273-1, 46쪽
- ↑ 가 나 호아글랜드 2001, 116-117쪽
- ↑ tRNA Structure
- ↑ Pulves 2006, 928-929쪽
- ↑ 쿠로타미 아케미, 최동헌역, 《교과서보다 쉬운 세포 이야기》, 푸른숲, 2004년, ISBN 978-89-7184-416-8, 108-109쪽
- ↑ David M. Sylvia, Jeffry J. Fuhrmann, Peter G. Hartel, David A. Zuberer, 신현동 외 역, 《토양미생물학 - 원리와 응용》, 동화기술교역, 2005년, 84쪽
- ↑ 과학동아 편집실, 《북극곰이 흰색인 이유》, 성우, 2003년, ISBN 978-89-8895-075-3, 138-139쪽
- ↑ 서울대학교의과대학미생물학교실, 《핵심 병원미생물학》,서울대학교출판부, 2006년, ISBN 978-89-5210-725-1, 46-47쪽
- ↑ Malacinski 2004, 208-209쪽
- ↑ Malacinski 2004, 210-211쪽
- ↑ 이종호, 《천재를 이긴 천재들 2》, 글항아리, 2007년, ISBN 978-89-5460-436-9, 320 쪽
- ↑ Futuyma, Douglas (1998). Evolutionary Biology. Sinauer Associates. p. Glossary. ISBN 0-87893-189-9.
- ↑ 멘델의 논문(영문): Gregor Mendel (1865). "Experiments in Plant Hybridization"
- ↑ 스티브 존스, 김혜원 역, 《진화하는 진화론》, 김영사. 2008년, ISBN 978-89-3492-869-0, 208-211쪽
- ↑ Pulves 2006, 163-168쪽
- ↑ Pulves 2006, 210-211쪽
- ↑ 강성구, 《인체유전학》, 아카데미서적, 2004년, ISBN 978-89-7616-248-9, 162-163쪽
- ↑ Balakrishnan L, Bambara RA (February 2013). “Okazaki fragment metabolism”. 《Cold Spring Harbor Perspectives in Biology》 5 (2): a010173. doi:10.1101/cshperspect.a010173. PMC 3552508. PMID 23378587.
- ↑ Pulves 2006, 216쪽
- ↑ 권이혁, 《인구 보건 환경》,서울대학교출판부, 2004년, ISBN 978-89-5210-566-0, 269-270쪽
- ↑ 조완규, 《발생생물학》, 아카데미서적, 2001년, ISBN 978-89-7616-220-5, 59-60쪽
- ↑ 가 나 Pulves 2006, 396쪽
- ↑ 사비네 레벤헤름, 유동환역, 《유전자 기술》, 푸른나무, 2008년, ISBN 978-89-7414-915-4, 23쪽
- ↑ Hans Winkler (1920). 《Verbreitung und Ursache der Parthenogenesis im Pflanzen - und Tierreiche》. Verlag Fischer, Jena.
- ↑ “How much information is stored in a human body?”. 2019년 3월 6일에 원본 문서에서 보존된 문서. 2019년 3월 3일에 확인함.
- ↑ “The human genome: Quick facts”. 2019년 3월 6일에 원본 문서에서 보존된 문서. 2019년 3월 3일에 확인함.
- ↑ Pulves 2006, 68쪽
- ↑ Pulves 2006, 270쪽
- ↑ 프리초프 카프라, 강주현 역, 《히든커넥션》,휘슬러, 2003년, ISBN 978-89-9045-707-3, 221-222쪽
- ↑ Pulves 2006, 163쪽
- ↑ STEPHEN M.ROTH, 이삼준 외 역, 《운동유전학》, 대한미디어, 2008년, ISBN 978-89-5654-214-0, 11쪽
- ↑ 이은희, 《하리하라의 바이오 사이언스 - 세상에서 가장 흥미로운 쇼 유전의 비밀, 유전과 생명공학》, 살림FRIENDS, 2009년, ISBN 978-89-5221-055-5, 115쪽
- ↑ 성전환하는 물고기가 있다구?, 한겨레, 2006년 4월 12일
- ↑ Pulves 2006, 199쪽
- ↑ 가 나 다 Malacinski 2004, 85-86쪽
- ↑ Pulves 2006, 163쪽
- ↑ Pulves 2006, 166-167쪽
- ↑ 강성구, 《인체유전학》, 아카데미서적, 2004년, ISBN 978-89-7616-248-9, 257쪽
- ↑ 유전과 염색체 Archived 2016년 8월 24일 - 웨이백 머신, 한림대학교
- ↑ ABL2, NCLB
- ↑ Malacinski 2004, 354-357쪽
- ↑ 스반테 페보, 김명주 역, 《잃어버린 게놈을 찾아서 - 네안데르탈인에서 데니소바인까지》, 부키, 2015년, ISBN 978-89-6051-512-3, 263-270쪽
- ↑ 박상대, 《분자세포생물학》, 아카데미서적, 1998년, ISBN 978-89-7616-176-5, 189쪽
- ↑ Schwartz, R.; Dayhoff, M. (1978). "Origins of prokaryotes, eukaryotes, mitochondria, and chloroplasts". Science. 199 (4327): 395–403. Bibcode:1978Sci...199..395S. doi:10.1126/science.202030. PMID 202030
- ↑ 엽록체 유전체, 국립생물자원관
- ↑ Miescher, Friedrich (1871) "Ueber die chemische Zusammensetzung der Eiterzellen" (고름잡힌 세포의 화학적 조성에 대해), Medicinisch-chemische Untersuchungen, 4: 441–460. From p. 456: "Ich habe mich daher später mit meinen Versuchen an die ganzen Kerne gehalten, die Trennung der Körper, die ich einstweilen ohne weiteres Präjudiz als lösliches und unlösliches Nuclein bezeichnen will, einem günstigeren Material überlassend. -- ("따라서 실험에서 나는 최소한 이 물질들이 세포의 다른 부분이 아니라 모두 핵에서 나온 것이라 편견 없이 특정할 수 있고 이렇게 분리하여 정제한 물질에 대해 핵에서 기원한 물질 (뉴클레인)이라고 명명한다.)
- ↑ 이스라엘 로젠필드 글, 보린 반 룬 그림, 이일권 역, 《DNA》, 이두 아이콘총서 Vol 8, 1997년, ISBN 89-502-0030-9, 8-10쪽
- ↑ 이스라엘 로젠필드 글, 보린 반 룬 그림, 이일권 역, 《DNA》, 이두 아이콘총서 Vol 8, 1997년, ISBN 89-502-0030-9, 20-22쪽
- ↑ 호아글랜드 2001, 83쪽
- ↑ Lorenz MG, Wackernagel W (1 September 1994). "Bacterial gene transfer by natural genetic transformation in the environment[깨진 링크(과거 내용 찾기)]". Microbiol. Rev. 58 (3): 563–602. PMID 7968924. PMC 372978.
Downie AW (1972). "Pneumococcal transformation—a backward view. Fourth Griffith Memorial Lecture". J. Gen. Microbiol. 73 (1): 1–11. PMID 4143929. - ↑ 위르겐 브라터, 안미라 역, 《즐거운 생물학》, 살림, 2009, ISBN 89-522-1086-7, 172-174쪽
- ↑ Avery O; MacLeod C; McCarty M (1944). “Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Inductions of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III”. 《J Exp Med》 79 (2): 137–158. doi:10.1084/jem.79.2.137.
- ↑ Hershey A; Chase M (1952). “Independent functions of viral protein and nucleic acid in growth of bacteriophage” (PDF). 《J Gen Physiol》 36 (1): 39–56. doi:10.1085/jgp.36.1.39. PMID 12981234.
- ↑ 이스라엘 로젠필드 글, 보린 반 룬 그림, 이일권 역, 《DNA》, 이두 아이콘총서 Vol 8, 1997년, ISBN 89-502-0030-9, 34-35쪽
- ↑ 생명의 비밀을 찾아나선 여정 Archived 2019년 3월 6일 - 웨이백 머신, LG사이언스랜드
- ↑ Lawrence Bragg Biographical, The Nobel Prize
- ↑ 이은희, 《하리하라의 바이오 사이언스 - 세상에서 가장 흥미로운 쇼 유전의 비밀, 유전과 생명공학》, 살림FRIENDS, 2009년, ISBN 978-89-5221-055-5, 81쪽
- ↑ "The instant I saw the picture my mouth fell open and my pulse began to race." -- James D. Watson (1968), The Double Helix, page 167. New York: Atheneum, Library of Congress card number 68-16217. Page 168 shows the X-shaped pattern of the B-form of DNA, clearly indicating crucial details of its helical structure to Watson and Crick.
- ↑ Double Helix: 50 Years of DNA. Nature archives. Nature Publishing Group
- ↑ Arthur Kornberg - Biographical, The Nobel Prize
- ↑ Malacinski 2004, 132-133쪽
- ↑ Hamilton O. Smith - Biographical, The Nobel Prize
- ↑ 이스라엘 로젠필드 글, 보린 반 룬 그림, 이일권 역, 《DNA》, 이두 아이콘총서 Vol 8, 1997년, ISBN 89-502-0030-9, 116-117쪽
- ↑ 최성우 (2018년 9월 28일). “크리스퍼 유전자가위, 원천특허는 누구에게?”. 《사이언스타임즈》. 2020년 4월 13일에 확인함.
- ↑ Malacinski 2004, 305-368쪽
- ↑ 김은진(2005. 12), ‘유전자조작 농산물의 개발현황과 문제점’, 진보평론, p.103
- ↑ 중국서 ‘유전자 편집’ 아기 출산, The Science Times
- ↑ Pulves 2006, 379쪽
- ↑ 최경석, 《인간 생명의 시작은 어디인가 윤리학 이야기, 배아줄기세포 연구와 생명 윤리》, 프로네시스, 2006년, ISBN 978-89-0105-478-0, 40-41쪽
- ↑ 정혜경 (2006년 1월 5일). “사이언스지, 황우석 교수 논문 철회 뜻 밝혀”. 《사이언스타임즈》. 2020년 4월 13일에 확인함.
- ↑ 과학수사의 새 지평, 유전자 감식, 대학원신문, 2017년 5월 9일
- ↑ 법유전자과 Archived 2019년 2월 18일 - 웨이백 머신, 국립과학수사연구원
- ↑ 유해발굴 추진절차 3단계: 신원확인 Archived 2019년 2월 18일 - 웨이백 머신, 국방부유해발굴감식단
- ↑ 신소영 (2014년 8월 29일). “헌재, "수형자 DNA 채취는 합헌"”. 《법률신문》. 2019년 3월 6일에 원본 문서에서 보존된 문서. 2020년 4월 13일에 확인함.
- ↑ 강성구, 《인체유전학》, 아카데미서적, 2004년, ISBN 978-89-7616-248-9, 273-274쪽
참고 문헌
편집- Malacinski, George M. (2004). 《분자생물학》. 번역 심웅섭 외. 월드사이언스. ISBN 89-5881-047-5.
- 존슨, 조지 B. (2007). 《생명 과학》. 번역 전병학. 동화기술. ISBN 89-425-1186-4.
- 호아글랜드, 말른; 도드슨, 버트 (2001). 《생명의 파노라마》. 번역 황현숙. 사이언스북스. ISBN 89-8371-050-0.
- Pulves, William K. (2006). 《생명 생물의 과학》. 번역 이광웅 외. 교보문고. ISBN 89-7085-516-5.