식세포
식세포(食細胞, 영어: phagocyte)는 유해한 이물질, 세균, 죽었거나 죽어가는 세포를 섭취하여 신체를 보호하는 세포이다. Phagocyte라는 용어는 '먹다' 또는 '삼키다'라는 뜻의 그리스어 'phagein'과 '세포'를 나타내는 생물학의 접미사인 '-cyte'에서 온 것으로, 후자는 '빈 용기'를 뜻하는 그리스어 'kutos'에서 유래하였다.[1] 식세포는 감염에 대항하며 이후의 면역 과정에 필수적이다.[2] 식세포는 동물계[3] 전체에서 중요하며 특히 척추동물에서 고도로 발달되어 왔다.[4] 사람의 혈액 1리터에는 약 60억 개의 식세포가 포함되어 있다.[5] 식세포는 1882년에 엘리 메치니코프가 불가사리 유생을 연구하는 중에 발견되었다.[6] 메치니코프는 이러한 발견으로 1908년에 노벨 생리학·의학상을 수상하였다.[7] 식세포는 많은 종에 존재한다. 일부 아메바는 대식세포처럼 행동하는데 이는 식세포가 생명의 진화 과정의 초기에 출현했음을 시사한다.[8]
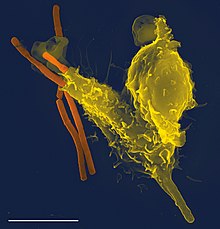
사람이나 다른 동물의 식세포는 '전문적'인 식세포와 '비전문적'인 식세포로 나뉘는데, 이 분류의 기준은 식세포가 얼마나 효율적으로 식작용을 하는지이다.[9] 전문 식세포는 호중구, 단핵구, 대식세포, 비만세포, 수지상세포와 같은 많은 종류의 백혈구를 포함한다.[10] 전문 식세포와 비전문 식세포 사이의 중요한 차이점은, 전문 식세포는 세균과 같은 일반적으로 우리 몸에서 발견되지 않는 유해한 물질을 감지하는 수용체라는 분자를 자신의 세포 표면에 발현한다는 점이다.[11] 식세포는 감염과 맞서 싸우고, 이미 죽었거나 수명이 다해 죽어가는 중인 세포들을 제거하여 건강한 조직을 유지하는 데에 중요하다.[12]
감염이 일어나면 화학적 신호가 발생하여 병원체가 몸을 침범한 장소로 식세포를 끌어 모은다. 이 화학적 신호는 세균이나 이미 와 있는 다른 식세포로부터 올 수 있다. 식세포는 주화성이라고 불리는 방법에 의해 움직인다. 식세포가 세균과 접촉하면 식세포의 표면에 있는 수용체가 세균과 결합한다. 결합이 일어나면 식세포가 세균을 탐식하게 된다.[13] 몇몇 식세포는 섭취한 병원체를 활성 산소종과 일산화 질소를 이용해서 죽인다.[14] 식작용이 일어난 이후, 대식세포와 수지상세포는 섭취한 외부 물질의 일부를 다시 자신의 표면으로 옮기는 항원제시에 참여할 수 있다. 표면에 나온 외부 물질은 면역계의 다른 세포들에게 제시된다. 일부 식세포는 그 후 온몸의 림프절을 돌아다니며 림프구라는 백혈구에게 표면에 낸 물질을 제시한다. 이 과정은 면역을 수립하는 데에 중요하다.[15] 많은 병원체는 식세포에 의한 공격을 피하는 많은 방법들을 진화시켜 왔다.[2]
역사
편집러시아의 생물학자인 엘리 메치니코프(1845–1916)는 미생물 감염을 방어하는 데에 특화된 세포들이 있다는 것을 처음 인지했다.[16] 1882년 그는 불가사리의 유생에 있는 운동성을 가진 세포들에 대해 연구했고, 이 세포들이 동물의 면역에 중요하다고 믿었다. 그의 아이디어를 테스트해 보기 위해 그는 유생에 탄제린 나무의 작은 가시를 넣었다. 몇 시간 뒤 그는 가시 주변을 움직이는 세포들이 둘러쌌다는 것을 알아차렸다.[16] 메치니코프는 빈으로 가 'phagocyte'('먹다'라는 뜻의 그리스어 단어 phagein과, '빈 용기'라는 뜻의 kutos[1]에서 유래함)라는 이름을 처음으로 제안했던 카를 프리드리히 빌헬름 클라우스에게 그의 아이디어를 공유했다.[17]
1년 정도 후, 메치니코프는 물벼룩(Daphnia)이라고 불리는 담수의 갑각류에 대해 연구했다. 물벼룩은 현미경으로 관찰 가능한 작고 투명한 동물이다. 그는 물벼룩을 공격한 진균의 포자가 식세포에 의해 파괴되었다는 것을 발견했다. 메치니코프는 그의 이 관찰을 포유류의 백혈구로 확장했고, 식세포가 탄저균(Bacillus anthracis)을 탐식해서 죽일 수 있다는 것을 발견했다. 그는 이 과정을 'phagocytosis'(식작용)라고 이름 붙였다.[18] 메치니코프는 식세포가 침투해 온 유기체에 대항하는 일차 방어선이라고 주장했다.[16]
메치니코프는 식작용과 식세포에 대한 공로를 인정받아 파울 에를리히와 함께 1908년 노벨 생리학·의학상을 수상했다.[7]
한편 1903년에는 암로스 라이트가 식작용이 그가 옵소닌(opsonin, 샐러드 드레싱이나 렐리시를 의미하는 그리스어 단어 'opson'에서 유래함)이라고 이름 붙인 특별한 항체에 의해 강화된다는 사실을 발견했다.[19]
이런 발견들이 20세기 초 느리게 받아들여졌지만, 식세포와 다른 면역계의 요소들 간의 복잡한 관계는 1980년대까지도 알려지지 않았었다.[20]
식작용
편집식작용은 세균, 기생충, 죽은 숙주 세포, 세포의 잔해 같은 입자들을 섭취하는 과정이다.[21] 여러 분자적 과정들이 연쇄적으로 일어나 식작용을 일으킨다.[22] 외부 물질이나 세균 세포 등이 식세포 표면의 수용체라는 분자에 결합하면 식작용이 일어나는데, 식세포가 늘어나 세균 주변을 둘러싸 탐식한다. 사람의 호중구가 식작용을 하는 데에는 평균적으로 9분 정도가 소요된다.[23] 식세포 안에 한 번 들어오게 되면, 세균은 파고솜이라는 소체 안에 갇히게 된다. 1분 정도 후 파고솜은 리소좀이나 과립과 융합하여 파고리소좀을 형성한다. 세균은 이후 각종 살해 기전에 당하게 되고[24] 수 분 후 사멸하게 된다.[23] 수지상세포와 대식세포는 식작용이 그리 빠르지 않으며, 이 세포들에서는 식작용이 몇 시간 걸릴 수 있다. 대식세포는 느리고 깔끔하지 못한 식세포인데, 이들은 많은 양의 물질을 탐식하고 종종 소화되지 않은 일부 물질을 조직으로 다시 방출한다. 방출된 이 파편들은 혈액에서 더 많은 식세포를 동원하는 신호 역할을 한다.[25] 식세포들은 게걸스러울 정도의 식욕을 가지고 있는데, 과학자들은 아예 대식세포에게 철가루를 탐식시킨 후 자석을 통해 다른 세포들에서 떼어내기도 했다.[25]
식세포는 표면에 여러 물질과 결합하기 위한 다양한 종류의 수용체를 발현하고 있다.[2] 발현하는 수용체에는 옵소닌 수용체, 청소제 수용체, 톨유사수용체 등이 있다. 옵소닌 수용체는 면역글로불린 G(IgG) 항체나 보체 단백질로 둘러싸인 세균의 식작용을 강화하는 역할을 한다. '보체'는 세포를 파괴하거나 파괴를 위해 남기는 표식 역할을 하는 혈액의 다양한 단백질 분자이다.[26] 청소제 수용체는 세균 세포 표면의 광범위한 분자들과 결합한다. 톨유사수용체는 초파리에 존재하는 Toll(톨) 유전자에 의해 암호화되는 잘 연구된 수용체와 유사하다고 하여 이런 이름이 붙여졌으며, 청소제 수용체보다 분자에 더 특이적으로 결합한다. 톨유사수용체에 맞는 리간드가 결합하면 식작용이 강화되며 식세포가 염증을 유발하는 호르몬을 분비하도록 만든다.[2]
살균 방법
편집미생물을 죽이는 것은 식세포 안쪽(세포내, intracellular)과 바깥쪽(세포외, extracellular)에서 모두 일어나는 식세포의 중요한 작용이다.[27]
산소 의존성, 세포내
편집식세포가 세균이나 다른 물질을 섭취하면 산소 소비량이 증가한다. 이렇게 산소 소비량이 증가하는 현상을 호흡폭발이라고 하며, 호흡폭발이 발생하면 식세포는 항미생물성을 가진 활성 산소를 포함하는 물질을 생산한다.[28] 산소 화합물은 침투해 온 미생물과 세포 그 자신 양쪽 모두에게 유독하여, 평소에는 세포 안에 칸으로 나누어져 보관된다. 이런 산소를 포함하는 분자로 침투한 미생물을 죽이는 방법을 산소 의존성 세포내 살균(oxygen-dependent intracellular killing)이라고 하며, 다시 두 가지 유형으로 나뉜다.[14]
첫 번째 유형은 초과산화물을 산소에 의존해 생산하는 것으로,[2] 초과산화물은 산소가 풍부한 세균을 죽이는 물질이다.[29] 초과산화물은 초과산화물 불균등화효소라는 효소에 의해 과산화 수소와 산소 분자로 변환된다. 또한 초과산화물은 과산화 수소와 반응하여, 침투한 미생물을 죽이는 걸 보조하는 하이드록실 라디칼을 생산한다.[2]
두 번째 유형은 호중구 과립에서 나오는 골수세포형과산화효소를 사용한다.[30] 과립이 파고솜과 융합되면 골수세포형과산화효소가 파고리소좀 안으로 방출되며, 이 효소는 과산화 수소와 염소를 이용하여 차아염소산염을 만든다. 차아염소산염은 가정용 표백제로도 사용되는 물질로, 세균에게 극도의 독성을 가진다.[2] 골수세포형과산화효소는 헴 색소를 포함하고 있다. 헴 색소는 고름이나 객담(가래)과 같이 호중구가 풍부한 분비물이 녹색으로 보이게 한다.[31]
산소 비의존성, 세포내
편집식세포는 산소와 독립적인 방법으로 미생물을 죽일 수도 있으나, 산소 의존성 방법에 비해 효과적이지는 않다. 산소 비의존성 방법에는 네 가지 주요 유형이 있다. 첫 번째 유형은 세균의 세포막에 손상을 주는 전하를 띈 단백질을 이용한다. 두 번째 유형은 리소좀의 효소로 세균의 세포벽을 파괴하는 방법이다. 세 번째 유형은 호중구 과립에 존재하는 락토페린을 이용하여, 세균에게 필수적인 철을 빼앗는 방법이다.[32] 네 번째 유형은 단백질분해효소와 가수분해효소를 이용하는 방법으로, 이 효소들은 파괴된 세균의 단백질을 소화하는 데에 쓰인다.[33]
세포외
편집인터페론 감마는 대식세포가 일산화 질소를 생산하도록 자극한다. 인터페론 감마를 분비하는 세포에는 보조 T세포(CD4+ T세포)와 세포독성 T세포(CD8+ T세포), 자연 살해 세포(NK세포), 단핵구, 대식세포, 수지상세포 등이 있다.[34] 대식세포에서 방출된 일산화 질소는 그 독성으로 인해 대식세포 근처의 미생물을 죽이게 된다.[2] 활성화된 대식세포는 종양괴사인자를 생산하고 분비한다. 종양괴사인자는 신호 분자인 사이토카인의 일종으로,[35]암 세포나 바이러스에 감염된 세포를 죽이고 면역계의 다른 세포가 활성화되는 것을 돕는다.[36]
만성 육아종병과 같은 몇몇 질병에서는 식세포의 능력이 손상되어, 재발성 세균 감염이 문제가 된다.[37] 이 질병에서는 산소 의존성 살균 기전의 여러 요소에 악영향을 끼치는 비정상이 발생한다. 체디아크-히가시 증후군과 같은 다른 희귀한 선천성 기형 환자도 섭취된 미생물을 살해하는 능력에 결함이 있다.[38]
바이러스
편집바이러스는 오로지 세포 안에서만 증식할 수 있으며, 세포 안으로 들어오기 위해서 바이러스는 면역에 관련된 다양한 수용체를 이용한다. 한 번 세포 안으로 들어온 바이러스는 자신을 위해 세포의 생물학적 시스템을 이용하여, 세포가 바이러스와 똑같은 복제본을 수백 개 이상 만들도록 강제한다. 선천면역계의 식세포와 다른 요소들이 바이러스를 제한된 범위 내에서는 조절할 수 있지만, 바이러스가 한 번 세포 내로 들어오면 특히 림프구와 같은 적응면역 반응이 방어에 더 중요하다.[39] 바이러스가 감염된 곳에서, 림프구는 종종 면역계의 다른 세포들보다도 훨씬 많이 존재하게 되며, 바이러스성 수막염에서 흔히 나타난다.[40] 림프구에 의해 살해된 바이러스에 감염된 세포는 식세포에 의해 몸에서 제거된다.[41]
세포자살에서의 역할
편집동물에서 세포들은 수명이 다하면 꾸준히 죽는다. 세포분열과 죽는 세포 간에 균형이 맞춰져 있으므로, 성인에서 세포의 숫자는 비교적 잘 유지된다.[12] 세포가 죽는 데에는 괴사와 세포자살이라는 두 가지 서로 다른 방법이 있다. 괴사는 종종 질병이나 외상에 의해 일어나지만 세포자살(또는 세포예정사, programmed cell death)은 세포의 정상적인 기능이다. 몸은 죽었거나 죽어가는 중인 자신의 세포를 매일 수백만 개씩 제거해야 하며, 식세포는 이 제거 과정에 핵심적인 역할을 한다.[42]
세포자살의 마지막 단계를 거치는 중인 죽어가는 세포들[43]은 식세포를 끌어 모으기 위해 포스파티딜세린과 같은 분자들을 표면에 발현한다.[44] 포스파티딜세린은 세포막의 세포질 쪽 표면에서 정상적으로 발견되지만 세포자살 과정이 일어날 때는 스크렘블레이스라는 단백질에 의해 세포막의 세포 바깥쪽 표면으로 위치가 바뀐다.[45][46] 이 분자들은 대식세포와 같이 적절한 수용체를 가진 세포에 의한 식작용이 일어날 세포를 표시하는 역할을 한다.[47] 식세포에 의해 죽는 세포를 제거하는 과정은 염증 반응을 유발하지 않는 평화로운 방식으로 일어나며, 식세포의 중요한 기능 중 하나이다.[48]
다른 세포들과의 상호작용
편집식세포는 보통 특정한 장기에 결합하지 않고 온몸을 떠돌아 다니며 다른 식세포나 식세포가 아닌 면역계의 세포들과 상호작용한다. 식세포들은 사이토카인이라는 화학 물질을 생산하여 다른 세포들과 신호를 주고받고, 이를 통해 감염 장소로 다른 식세포를 동원하거나 휴면 상태의 림프구를 자극한다.[49] 식세포는 사람을 포함한 동물들에서 태어날 때부터 존재하는 선천면역의 일부이다. 선천면역은 매우 효과적이지만 침투한 물질들 간에 구별하는 능력은 적어 비특이적이다. 반면에 유악류에서 발달한 적응면역은 고도로 특화되어 있으며 거의 모든 종류의 물질에 대응할 수 있다.[50] 적응면역계는 식세포가 아닌, 림프구에 의존적이다. 림프구는 항체라고 불리는 단백질을 생산하며, 항체는 침투한 물질에 붙어서 그 물질을 파괴하고 바이러스가 세포를 감염시키는 것을 방지한다.[51] 특히 수지상세포와 대식세포를 포함한 식세포는 항원제시라는 중요한 과정을 통해 림프구가 항체를 생산하도록 자극한다.[52]
항원제시
편집항원제시는 몇몇 식세포가 탐식한 물질을 세포 표면으로 돌려보내 면역계의 다른 세포들에게 제시하는 과정이다.[53] 항원제시에 관여하는 두 '전문' 항원제시세포는 대식세포와 수지상세포이다.[54] 탐식된 이후 외부 단백질(항원)은 수지상세포나 대식세포 안에서 펩타이드 단위로 쪼개진다. 쪼개진 펩타이드는 세포의 주조직 적합성 복합체(MHC 분자)라는 당단백질에 붙게 된다. MHC 분자는 펩타이드를 식세포의 표면으로 다시 돌려보내 림프구에게 항원으로서 제시될 수 있게 만든다.[15] 성숙한 대식세포는 감염이 일어난 곳으로부터 멀리 이동하지 않으나 수지상세포는 수백만 개의 림프구가 모여 있는 림프절에 도달한다.[55] 림프구는 수지상세포가 원래 감염이 있던 장소에서 운반해 온 항원에 반응하고, 이로 인해 면역이 강화된다.[56] 그러나 만약 수지상세포가 우리 몸(숙주)의 구성 성분을 인식했을 때는 오히려 림프구를 파괴하거나 진정시킬 수 있는데, 이 과정은 자가 면역을 방지하는 데에 필수적이다. 숙주의 성분을 인식했을 때 일어나는 이런 과정을 면역관용(immune tolerance)이라고 한다.[57]
면역관용
편집수지상세포는 우리 몸이 스스로를 공격하는 것을 막는 면역관용을 촉진한다.[58] 면역관용의 첫 번째 단계는 중추관용으로, 가슴샘에서 일어난다. 가슴샘에서 수지상세포가 MHC 분자에 붙여 제시한 자가 항원에 자신의 T세포 수용체가 너무 강하게 결합한 T세포는 죽게 된다. 면역관용의 두 번째 유형은 말초관용이다. 여러 이유로 인해 약간의 자가반응성 T세포는 가슴샘을 빠져나가게 된다. 자가반응성 T세포가 빠져나가는 주된 이유는 가슴샘에서 자가 항원 발현이 약간 부족하기 때문이다. 또 다른 유형의 T세포인 조절 T세포는 말초에서 자가반응성 T세포를 하향조절할 수 있다.[59] 면역관용에 실패한다면 면역계가 우리 몸을 공격하면서 자가 면역 질환이 발생할 수 있다.[60]
전문 식세포
편집사람과 다른 유악류의 식세포는 식작용 관여 시의 효율에 따라 '전문'(professional) 식세포와 '비전문'(non-professional) 식세포로 나누어진다.[9] 전문 식세포에는 단핵구, 대식세포, 호중구, 조직 수지상세포, 비만세포가 있다.[10] 1리터의 사람 혈액에는 대략 60억 개의 식세포가 포함되어 있다.[5]
활성화
편집모든 식세포(특히 대식세포)는 항상 준비 상태로 존재한다. 대식세포는 대부분 조직에서 비교적 휴면 상태로 존재하며 느리게 증식한다. 이 준-휴식(semi-resting) 상태에서 대식세포는 몸의 죽은 세포나 비감염성 물질을 치우고, 항원제시에는 드물게 참여한다. 그러나 감염이 발생하면 대식세포는 인터페론 감마와 같은 화학 신호를 받고, 제2형 주조직 적합성 복합체(MHC class II) 생산을 증가시켜 항원을 제시할 준비를 한다. 이 상태에서 대식세포는 항원제시와 병원체를 죽이는 능력이 좋아진다. 만일 침투한 병원체로부터 직접 신호를 받게 되면 대식세포는 과활성화(hyperactivate)된다. 과활성화 시 대식세포는 증식을 멈추고 오로지 적을 죽이는 데에만 집중한다. 대식세포의 크기와 식작용의 속도가 상승하며, 일부 대식세포는 침투한 원생동물을 충분히 통째로 탐식할 만큼 커진다.[61]
혈액 내에서 호중구는 비활성화 상태지만 빠르게 혈류를 지나다닌다. 호중구가 염증이 발생한 장소의 대식세포로부터 신호를 받으면 호중구는 속도를 줄이고 혈액을 떠난다. 조직에서 호중구는 사이토카인에 의해 활성화되어 적을 죽일 준비를 한 채로 감염 장소에 도착한다.[62]
이동
편집감염이 일어나면 그 장소로 식세포를 끌어 모으기 위한 화학적인 'SOS' 신호가 발생한다.[63] 이 화학적 신호는 침투한 세균으로부터 나온 단백질이나 혈액 응고계의 펩타이드, 보체계의 생산물, 감염된 장소 근처의 조직에 있던 대식세포가 방출한 사이토카인 등을 포함할 수 있다.[2] 사이토카인은 혈액으로부터 호중구와 단핵구를 동원한다.[13]
감염 장소에 도착하기 위해서 식세포는 혈류를 떠나서 감염된 조직으로 들어가야 한다. 감염으로부터 나온 신호는 혈관을 덮고 있는 내피세포가 셀렉틴이라는 단백질을 만들어, 호중구가 셀렉틴에 붙어서 이동할 수 있게 한다. 또 다른 신호는 내피세포 사이를 잇는 접합부를 느슨하게 만들어, 식세포가 혈관벽 사이를 지나갈 수 있게 만든다. 주화성은 식세포가 사이토카인을 따라 감염 장소로 갈 수 있게 만드는 과정이다.[2] 호중구는 내피세포에 의해 싸인 장기를 따라 이동하며, 이 과정이 감염과 싸우는 데에 있어 중요한 요소지만, 이동하는 중에는 질병과 비슷한 증상을 일으킬 수 있다.[64] 감염이 일어났을 때는 수백만 개의 호중구가 혈액에서 동원되지만, 며칠이 지나면 사멸한다.[65]
단핵구
편집단핵구는 골수에서 발생하여 혈액에서 성숙한다. 성숙한 단핵구는 크고 부드러운, 엽으로 나누어진 핵을 가지며 과립을 포함한 풍부한 세포질로 이루어져 있다. 단핵구는 이물질이나 위험한 물질을 섭취하여 면역계의 다른 세포에게 항원으로 제시한다. 단핵구는 순환하는(circulating) 그룹과 가장자리(marginal) 그룹의 두 그룹을 형성한다. 대략 70% 정도는 가장자리 그룹이다. 대다수 단핵구는 20-40시간이 지나면 혈류를 떠나 조직이나 장기로 이동하고, 그곳에서 받은 신호에 따라 대식세포[66]나 수지상세포로 변한다.[67] 1리터의 사람 혈액에는 약 5억 개의 단핵구가 포함되어 있다.[5]
대식세포
편집성숙한 대식세포(매크로파지)는 멀리 이동하지 않고 외부에 노출된 몸의 일부 영역을 지킨다. 그곳에서 받는 신호에 따라 어떨 때는 쓰레기 수거원처럼, 어떨 때는 항원제시세포로, 어떨 때는 흉포한 살균 세포로 행동한다.[68] 단핵구나 과립구 줄기세포로부터 유래되거나, 이미 존재하는 대식세포의 세포분열에 의해 형성된다.[69] 사람의 대식세포는 직경이 대략 21마이크로미터이다.[70]
대식세포에는 과립이 없지만, 대신 대식세포는 많은 리소좀을 가지고 있다. 대식세포는 우리 몸의 거의 모든 조직과 장기에서 조용히 대기 중인 상태로 발견된다. 그 예로는 뇌의 미세 아교 세포나 폐의 폐포대식세포 등이 있다. 대식세포는 그 위치에 따라 크기와 겉모습이 다르다. 대식세포가 염증을 일으키는 방식은 인터루킨 1, 인터루킨 6, 종양괴사인자 알파 같은 물질을 생산하는 것이다.[71] 대부분의 대식세포는 조직에서 발견되며 혈액 순환에서는 드물게 발견된다. 조직 대식세포의 수명은 4-15일 정도로 추정된다.[72]
대식세포는 휴식 중인 단핵구가 할 수 없는 기능을 하기 위해 활성화될 수 있다.[71] 림프구의 한 아집단(sub-group)인 보조 T세포(Th)는 대식세포를 활성화하는 역할을 하는데, Th1 세포는 인터페론 감마 신호를 보내고 CD40 리간드(CD40L) 단백질을 제시해 대식세포를 활성화시킨다.[73] 다른 신호에는 종양괴사인자 알파나 세균의 지질다당류 등이 있다.[71] Th1 세포는 여러 가지 방법으로 다른 식세포를 감염 장소로 동원할 수 있다. 구체적으로는 골수에서 단핵구와 호중구 생산을 자극하는 사이토카인이나, 혈액 밖으로 단핵구와 호중구가 이동하는 데에 필요한 사이토카인을 분비한다.[74] Th1 세포는 이차 림프 기관에서 항원에 반응한 이후의 CD4+ T세포의 세포 분화를 통해 형성된다.[71] 활성화된 대식세포는 종양괴사인자 알파, 인터페론 감마, 일산화 질소, 활성 산소종, 양이온성 단백질, 가수 분해 효소 등을 생산하여 종양을 파괴하는 데에 중요한 역할을 한다.[71]
호중구
편집호중구는 혈류 안에서 흔히 찾아볼 수 있으며 식세포 중에서 가장 수가 많은 유형이다. 그 수는 순환 중인 총 백혈구의 50-60% 정도를 차지한다.[75] 1리터의 사람 혈액은 약 50억 개의 호중구를 포함하며,[5] 호중구 하나의 직경은 대략 10마이크로미터이다.[76] 수명은 5일 정도로 짧다.[36] 호중구가 적절한 신호를 받으면, 혈액을 떠나서 감염 장소에 도달하는 데까지 약 30분 정도가 소요된다.[77] 호중구는 난폭한 포식자이며 항체와 보체 단백질로 싸여 있는 침투 물질이나 손상된 세포, 세포 파편 등을 빠르게 탐식한다. 탐식한 이후 호중구는 혈액으로 돌아가지 않으며 고름으로 변하고 죽는다.[77] 성숙한 호중구는 단핵구보다 작으며 여러 부분으로 분할된 세포핵을 가지고 있다. 각각의 나누어진 부분은 염색질 필라멘트로 이어져 있으며 호중구는 2-5개의 부분으로 세포핵이 이루어져 있다. 호중구는 성숙 때까지 골수를 평범하게 나가지 않고, 감염이 일어났을 때 호중구의 전구세포(precursor)인 후골수구, 골수구, 전골수구가 골수에서 방출된다.[78]
사람 호중구 안의 과립은 오래 전부터 단백질을 파괴하고 세균을 죽이는 속성이 있다는 것이 알려져 있었다.[79] 호중구는 단핵구와 대식세포를 자극하는 물질을 분비할 수 있다. 이 분비물은 식작용과 세포내 살균에 관여하는 활성 산소종의 생산을 증가시킨다.[80] 호중구의 아주르친화성 과립에서 분비된 물질은 면역글로불린 G 항체로 싸인 세균을 포식하도록 자극한다.[81] 세균이나 진균, 활성화된 혈소판을 마주치면 호중구는 호중구 세포외 덫(NETs)이라는 그물 같은 염색질 구조물을 만들어 낸다. NETs는 주로 DNA로 이루어져 있으며, 네토시스(netosis)라는 과정을 통해 대상을 죽인다. 병원체가 NETs에 잡히면 여러 산화적, 비산화적 기전에 의해 사멸된다.[82]
수지상세포
편집수지상세포는 나뭇가지처럼 긴 가지(dendrite)가 길게 밖으로 뻗어 있는 모양의, 매우 특화된 항원제시세포이다.[83] 항원제시를 통해 수지상세포는 미생물이나 다른 침투한 물질을 탐식하는 것을 돕는다.[84][85] 수지상세포는 피부, 코 안쪽, 폐, 위, 창자와 같이 외부 환경과 맞닿는 부분의 조직에 존재한다.[86] 수지상세포는 활성화되면 성숙하여 림프 조직으로 이동하고, 그곳에서 T세포, B세포와 상호작용하여 적응면역 반응을 시작, 지휘한다.[87] 성숙한 수지상세포는 보조 T세포와 세포독성 T세포를 활성화시킬 수 있다.[88] 활성화된 보조 T세포는 차례로 대식세포, B세포와 상호작용하여 그들을 활성화시킨다. 추가로, 수지상세포는 어떤 종류의 면역 반응을 유발하는 데에도 영향을 준다. 수지상세포가 T세포가 존재하는 영역에 도달하면 T세포를 자극하는데, 이후 이 T세포는 세포독성 T세포나 보조 T세포로 분화한다.[84]
비만세포
편집비만세포는 톨유사수용체를 가지고 있으며 수지상세포, B세포, T세포와 상호작용하여 적응면역 기능을 중재하는 걸 돕는다.[89] 비만세포는 제2형 주조직 적합성 복합체 분자를 발현하여 항원제시에 참여한다. 그러나, 항원제시에서 비만세포가 하는 기능은 아직 잘 이해되어 있지 않다.[90] 비만세포는 그람 음성균(예: 살모넬라)을 탐식하고 살해한 후, 세균의 항원을 처리할 수 있다.[91] 특히 숙주 조직에 세균을 부착시키는 역할을 하는 세균 표면의 섬모 단백질을 처리하는 데에 특화되어 있다.[92][93] 이 기능들에 더해 추가적으로, 비만세포는 염증 반응을 유도하는 사이토카인을 생산한다.[94] 사이토카인 분비는 미생물 파괴의 핵심적인 부분인데, 사이토카인이 감염 장소로 더 많은 식세포를 끌어 모으기 때문이다.[91][95]
| 주된 위치 | 표현형의 다양성 |
|---|---|
| 혈액 | 호중구, 단핵구 |
| 골수 | 대식세포, 단핵구, 굴모양혈관 세포, 일부 상피세포 |
| 뼈 조직 | 파골세포 |
| 위장관의 파이어판 | 대식세포 |
| 결합조직 | 조직구, 대식세포, 단핵구, 수지상세포 |
| 간 | 쿠퍼 세포, 단핵구 |
| 폐 | 폐포대식세포, 단핵구, 비만세포, 수지상세포 |
| 림프 조직 | 자유, 고정 대식세포와 단핵구, 수지상세포 |
| 신경 조직 | 미세 아교 세포 (CD4+) |
| 지라 | 자유 및 고정 대식세포, 단핵구, 굴모양혈관 세포 |
| 가슴샘 | 자유 및 고정 대식세포, 단핵구 |
| 피부 | 상주 랑게르한스 세포, 기타 수지상세포, 일반적인 대식세포, 비만세포 |
비전문 식세포
편집죽어가는 세포와 외부로부터 유입된 유기체는 전문 식세포 이외의 다른 세포들에 의해 더 많이 포식된다.[97] 이런 다른 세포들에는 상피세포, 내피세포, 섬유아세포, 간엽 세포 등이 있다. 이들은 전문 식세포와 대조하여, 식작용이 그들의 주된 작용은 아니란 것을 강조하기 위해 비전문 식세포라고 불린다.[98] 예를 들어 섬유아세포는 상처가 치유되는 과정에서 콜라겐을 식작용으로 포식하고, 외부 입자를 섭취하려는 약간의 시도를 한다.[99]
비전문 식세포는 전문 식세포보다 섭취 가능한 입자의 종류가 제한되어 있다. 이는 비전문 식세포의 표면에는 충분한 수용체가 없기 때문이며, 특히 옵소닌(침투한 외부 물질에 결합하는 항체와 보체)과 결합하는 수용체가 부족하다.[11] 또한 대부분의 비전문 식세포는 식작용에 대한 반응으로 활성 산소종을 생산하지 않는다.[100]
| 주 위치 | 표현형의 다양성 |
|---|---|
| 혈액, 림프, 림프절 | 림프구 |
| 혈액, 림프, 림프절 | 자연 살해 세포, 거대과립림프구(LGL) |
| 혈액 | 호산구, 호염기구[101] |
| 피부 | 상피세포 |
| 혈관 | 내피세포 |
| 결합조직 | 섬유아세포 |
병원체의 식세포 회피와 저항
편집병원체는 숙주 방어를 뚫어야만 숙주를 감염시킬 수 있다. 병원성 세균과 원생동물(원충)은 식세포의 공격에 저항하는 다양한 방법을 발전시켜 왔으며, 다수 병원체가 식세포에게서 살아남고 오히려 그 안에서 복제를 이어나갈 수 있다.[102][103]
접촉 회피
편집식세포와의 접촉을 세균이 회피하는 다양한 방법이 있다. 첫째, 식세포가 이동해 올 수 없는 곳에서 자랄 수 있다. 예를 들어 상처가 없는 피부 표면에는 식세포가 올 수 없다. 둘째, 세균이 염증을 억제할 수 있다. 염증 없이는 식세포가 감염에 제대로 반응할 수 없다. 셋째, 일부 세균은 주화성 과정에 간섭하여 식세포가 감염 장소로 이동하지 못하게 만들 수 있다.[102] 넷째, 몇몇 세균은 자기가 숙주 세포의 일부(자기, self)라고 면역계를 속여서 식세포를 회피할 수 있다. 매독의 원인균인 매독균(Treponema pallidum)은 자신의 표면을 피브로넥틴으로 덮어 식세포에게서 숨는다.[104] 피브로넥틴은 몸에서 자연적으로 생산되며 상처 치유에서 중요한 역할을 한다.[105]
탐식 회피
편집세균은 종종 단백질이나 당으로 이루어진 협막을 생산한다. 협막은 세균의 세포 주변을 둘러싸고 식작용을 방해한다.[102] 예시로는 대장균(Escherichia coli) 표면의 K5 협막과 O75 O 항원이나,[106] 표피포도상구균(Staphylococcus epidermidis)의 세포밖다당류 협막이 있다.[107] 폐렴구균(Streptococcus pneumoniae)은 각기 다른 정도로 식작용을 방어하는 여러 종류의 협막을 생산하고,[108] A군 연쇄상구균은 M 단백질과 같은 단백질이나 선모 단백질을 생산하여 탐식을 회피한다. 몇몇 단백질은 옵소닌 연관 섭취를 방해한다. 황색포도상구균은 항체 수용체를 막는 단백질 A를 생산하여 옵소닌의 효과를 감소시킨다.[109] 예르시니아속에 속하는 장병원성 종들은 식세포 수용체에 독성 인자인 YopH를 결합시켜 식작용 능력에 영향을 미친다.[110]
식세포 안에서 생존
편집세균은 면역계를 회피할 수 있는 공간인 식세포 안에서 생존하는 방법들을 발전시켰다.[111] 식세포 안으로 안전하게 들어가기 위해 세균들은 인베이신이라는 단백질을 발현한다. 식세포 안에서는 세포질에 머무르며 파고리소좀 안에 있는 독성 화학 물질을 피한다.[112]
몇몇 세균은 파고솜와 리소좀의 융합해 파고리소좀을 형성하는 과정을 막는다.[102] 리슈만편모충(Leishmania)와 같은 다른 병원체들은 식세포 안에서 크게 변형된 공포를 만드는데, 이것은 병원체가 지속적으로 안에서 복제할 수 있게 돕는다.[113] 일부 세균은 파고리소좀 안에서 생존할 수 있다. 예를 들어 황색포도상구균은 카탈레이스와 초과산화물 불균등화효소를 생산하여 과산화 수소와 같은 식세포가 세균을 죽이기 위해 사용하는 화학 물질들을 분해한다.[114] 세균은 파고리소좀이 형성되기 전에 파고솜에서 탈출할 수도 있다. 리스테리아 모노사이토제네스(Listeria monocytogenes)는 리스테리오라이신 O나 인지질분해효소 C(PLC)라는 효소를 이용하여 파고솜의 벽에 구멍을 뚫고 빠져나간다.[115] 리케차 역시 파고솜을 통해 식세포 안으로 들어온 뒤 금방 파고솜을 탈출하여 식세포의 세포질 안에서 증식한다. 탈출 시 파고솜의 막을 뚫을 때는 인지질분해효소 A(PLA) 같은 효소가 사용되는 것으로 보인다.[102]
식세포 살해
편집세균은 식세포를 역으로 살해하는 다양한 방식들을 발전시켰다.[109] 예시로는 식세포의 세포막에 구멍을 뚫는 효소인 세포용해소(사이토라이신)나, 호중구의 과립이 파열되어 독성 물질이 방출되도록 만드는 스트렙토라이신과 류코시딘,[116][117] 식세포의 식작용에 필요한 ATP 공급을 감소시키는 외독소가 있다. 또는 세균이 섭취된 이후, 세균이 독소를 방출하여 파고솜이나 파고리소좀의 막에 작용할 수 있다. 그러면 식세포의 다른 부분에 파고솜과 파고리소좀의 효소가 작용하여 식세포를 죽이게 된다.[102]
세포 신호 방해
편집몇몇 세균의 생존 전략은 사이토카인이나 다른 세포 신호를 방해하여 식세포가 침투한 병원체에 반응하는 것을 막는 방법이다.[118] 원충성 기생충인 톡소포자충(Toxoplasma gondii), 크루스파동편모충(Trypanosoma cruzi), 리슈만편모충(Leishmania) 등은 대식세포를 감염시키며, 각자 대식세포를 방해하는 독특한 방법을 가지고 있다.[118] 리슈만편모충에 속하는 몇몇 종은 감염된 대식세포의 신호를 바꾸어 사이토카인이나 항미생물 분자(일산화 질소, 활성 산소종 등)의 생산을 억제하고 항원제시 과정을 막는다.[119]
식세포에 의한 숙주 손상
편집식세포 중에서도 특히 대식세포와 호중구는 저분자의 염증 매개 분자를 방출하여 염증 과정에 중심적인 역할을 한다. 염증 과정은 감염을 조절하지만 숙주 조직에 손상을 입힐 수 있다. 일반적으로 식세포는 병원체를 탐식하여, 파고리소좀 안에 집어넣고 독성 물질을 이용해 병원체만을 노리고 파괴한다. 만약 식세포가 목표 병원체를 탐식하는 데에 실패한다면 이런 독성 물질이 바깥으로 방출될 수 있다. 이런 물질은 숙주 세포에도 독성을 띄므로 건강한 세포와 조직에 광범위한 손상을 유발할 수 있다.[120]
호중구가 콩팥에서 과립의 내용물을 방출하면, 과립의 내용물인 활성 산소종과 단백질분해효소가 숙주 세포의 세포외기질을 분해하고, 사구체 세포에 손상을 입혀 혈액을 여과하는 능력에 악영향을 주고 모양에 변화를 일으킨다. 또한, 인지질분해효소의 생산물인 류코트리엔 등은 손상을 심화시킨다. 류코트리엔 같은 물질은 더 많은 호중구가 감염 부위로 더 많이 동원되도록 주화성을 유발하고, 그 과정에서 사구체 세포는 호중구가 이동 과정에서 발현하는 부착 분자로 인해 더 많은 손상을 입을 수 있다. 사구체 세포에 발생한 손상은 신부전의 원인이 될 수 있다.[121]
또한 호중구는 대부분의 급성 폐 손상 발생에 핵심적인 역할을 한다.[122] 활성화된 호중구는 과립 안의 독성 물질을 폐 안으로 방출한다.[123] 한 실험은 호중구 숫자가 줄어들면 급성 폐 손상이 완화된다는 것을 보였다.[124] 그러나 호중구 활동을 막아 급성 폐 손상을 치료하는 것은 임상적으로 현실적이지 못한데, 호중구가 작용하지 않으면 숙주는 감염에 취약해지기 때문이다.[123] 세균이 만든 내독소가 방출되거나, 패혈증, 외상, 알코올성 간염, 허혈, 급성 출혈로 인한 저혈량성 쇼크 등의 원인으로 호중구가 활성화되면, 간을 손상시켜 기능 장애의 원인이 될 수 있다.[125]
대식세포에서 방출된 화학 물질들도 숙주 조직에 손상을 입힌다. 종양괴사인자 알파는 대식세포에서 방출되는 주요 화학 물질로, 작은 혈관의 혈액이 응고되어 감염이 확산되는 것을 막는 역할을 한다.[126] 만일 세균 감염이 혈액을 통해 퍼지면, 종양괴사인자 알파가 생명 활동에 필수적인 장기들로 방출되어 혈관 확장을 일으키고 혈장 부피를 감소시킬 수 있다. 이는 패혈성 쇼크로 이어질 수 있다. 패혈성 쇼크가 일어났을 때 종양괴사인자 알파는 계속 작용하여 주요 장기들로 가는 작은 혈관을 막고, 그 결과 장기가 부전에 빠질 수 있다. 패혈성 쇼크는 사망으로도 이어질 수 있는 위험한 상태이다.[13]
진화적 기원
편집식작용은 다양한 종의 생명체들에게서 발견할 수 있는 작용으로 진화 초기에[127] 단세포 진핵생물에서 처음 나타난 것으로 추정된다.[128] 특히 식물이 갈라진 직후 후생동물에서 갈라져 나온 단세포 원생생물 중에서도 아메바처럼 포유류의 식세포와 다양한 기능을 공유하는 생물이 있다.[128] 예를 들어, 딕티오스텔리움 디스코이데움(Dictyostelium discoideum)은 토양에 사는 아메바의 일종으로, 세균을 주식으로 한다. 동물의 식세포처럼 이 아메바는 주로 톨유사수용체를 통한 식작용으로 세균을 탐식하는 등 대식세포와 공유하는 생물학적 기능이 여럿 있다.[129] 딕티오스텔리움 디스코이데움은 먹을 것이 모자랄 경우 여럿이 모여서 다세포의 이동 가능한 형태인 슈도플라스모디움(pseudoplasmodium, slug)을 형성하는 등 사회적인 행동도 보인다. 이 다세포 유기체는 결국 환경의 위험에 저항성이 있는 포자와 자실체를 만들어 낸다. 자실체를 형성하기 전에, 여러 아메바 세포들이 뭉치기 위해 이동한다. 이 기간 동안 독소나 세균에 노출되면 포자 생산에 지장이 생겨 종의 생존에 위협이 될 가능성이 있다. 몇몇 아메바는 세균을 탐식하고 독소를 흡수하는데, 흡수한 아메바는 결국 죽게 된다. 죽은 아메바는 다세포 덩어리의 다른 아메바와 유전적으로 동일하다. 즉, 이 아메바가 다른 아메바들을 지키기 위해 하는 자기 희생은 고등 척추동물에서 식세포가 자신을 희생하는 것과 유사하다. 이 사회적 아메바에서의 오래된 면역 기능은 세포성 탐식 기전이 오래 전부터 진화적으로 보존되어 와서, 지금은 방어 기전으로 쓰이고 있다는 것을 시사한다.[130] 식세포는 동물계 전반에서 나타나며,[3] 이는 해면동물부터 곤충류, 고등 척추동물까지 전부 해당된다.[131][132] 아메바가 자기와 비자기(non-self)를 구별하는 능력은 매우 중요하며, 많은 종의 아메바의 면역계에서 뿌리 역할을 한다.[8]
같이 보기
편집각주
편집- ↑ 가 나 Little, C., Fowler H.W., Coulson J. (1983). 《The Shorter Oxford English Dictionary》. Oxford University Press (Guild Publishing). 1566–67쪽.
- ↑ 가 나 다 라 마 바 사 아 자 차 Delves 등. 2006, 2–10쪽
- ↑ 가 나 Delves 등. 2006, 250쪽
- ↑ Delves 등. 2006, 251쪽
- ↑ 가 나 다 라 Hoffbrand, Pettit & Moss 2005, 331쪽
- ↑ Ilya Mechnikov, retrieved on November 28, 2008. From Nobel Lectures, Physiology or Medicine 1901–1921, Elsevier Publishing Company, Amsterdam, 1967. 보관됨 8월 22, 2008 - 웨이백 머신
- ↑ 가 나 Schmalstieg, FC; AS Goldman (2008). “Ilya Ilich Metchnikoff (1845–1915) and Paul Ehrlich (1854–1915): the centennial of the 1908 Nobel Prize in Physiology or Medicine”. 《Journal of Medical Biography》 16 (2): 96–103. doi:10.1258/jmb.2008.008006. PMID 18463079. S2CID 25063709.
- ↑ 가 나 Janeway, Chapter: Evolution of the innate immune system. retrieved on March 20, 2009
- ↑ 가 나 Ernst & Stendahl 2006, 186쪽
- ↑ 가 나 Robinson & Babcock 1998, 187쪽, Ernst & Stendahl 2006, 7–10쪽
- ↑ 가 나 Ernst & Stendahl 2006, 10쪽
- ↑ 가 나 Thompson, CB (1995). “Apoptosis in the pathogenesis and treatment of disease”. 《Science》 267 (5203): 1456–62. Bibcode:1995Sci...267.1456T. doi:10.1126/science.7878464. PMID 7878464. S2CID 12991980.
- ↑ 가 나 다 Charles A Janeway, Jr; Travers, Paul; Walport, Mark; Shlomchik, Mark J. (2001). “Induced innate responses to infection”. 《Immunobiology: The Immune System in Health and Disease. 5th edition》 (영어).
- ↑ 가 나 Fang FC (October 2004). “Antimicrobial reactive oxygen and nitrogen species: concepts and controversies”. 《Nat. Rev. Microbiol.》 2 (10): 820–32. doi:10.1038/nrmicro1004. PMID 15378046. S2CID 11063073.
- ↑ 가 나 Delves 등. 2006, 172–84쪽
- ↑ 가 나 다 Kaufmann SH (2019). “Immunology's Coming of Age”. 《Frontiers in Immunology》 10: 684. doi:10.3389/fimmu.2019.00684. PMC 6456699. PMID 31001278.
- ↑ Aterman K (1998년 4월 1일). “Medals, memoirs—and Metchnikoff”. 《J. Leukoc. Biol.》 63 (4): 515–17. doi:10.1002/jlb.63.4.515. PMID 9544583. S2CID 44748502.
- ↑ “Ilya Mechnikov”. The Nobel Foundation. 2014년 12월 19일에 확인함.
- ↑ Delves 등. 2006, 263쪽
- ↑ Robinson & Babcock 1998, vii쪽
- ↑ Ernst & Stendahl 2006, 4쪽
- ↑ Ernst & Stendahl 2006, 78쪽
- ↑ 가 나 Hampton MB, Vissers MC, Winterbourn CC; Vissers; Winterbourn (February 1994). “A single assay for measuring the rates of phagocytosis and bacterial killing by neutrophils”. 《J. Leukoc. Biol.》 55 (2): 147–52. doi:10.1002/jlb.55.2.147. PMID 8301210. S2CID 44911791. 2012년 12월 28일에 원본 문서에서 보존된 문서. 2014년 12월 19일에 확인함.
- ↑ Delves 등. 2006, 6–7쪽
- ↑ 가 나 Sompayrac 2019, 2쪽
- ↑ Sompayrac 2019, 13–16쪽
- ↑ Dale DC, Boxer L, Liles WC; Boxer; Liles (August 2008). “The phagocytes: neutrophils and monocytes”. 《Blood》 112 (4): 935–45. doi:10.1182/blood-2007-12-077917. PMID 18684880. S2CID 746699.
- ↑ Dahlgren, C; A Karlsson (1999년 12월 17일). “Respiratory burst in human neutrophils”. 《Journal of Immunological Methods》 232 (1–2): 3–14. doi:10.1016/S0022-1759(99)00146-5. PMID 10618505.
- ↑ Shatwell, KP; AW Segal (1996). “NADPH oxidase”. 《The International Journal of Biochemistry & Cell Biology》 28 (11): 1191–95. doi:10.1016/S1357-2725(96)00084-2. PMID 9022278.
- ↑ Klebanoff SJ (1999). “Myeloperoxidase”. 《Proc. Assoc. Am. Physicians》 111 (5): 383–89. doi:10.1111/paa.1999.111.5.383. PMID 10519157.
- ↑ Meyer KC (September 2004). “Neutrophils, myeloperoxidase, and bronchiectasis in cystic fibrosis: green is not good”. 《J. Lab. Clin. Med.》 144 (3): 124–26. doi:10.1016/j.lab.2004.05.014. PMID 15478278.
- ↑ Hoffbrand, Pettit & Moss 2005, 118쪽
- ↑ Delves 등. 2006, 6–10쪽
- ↑ Schroder K, Hertzog PJ, Ravasi T, Hume DA; Hertzog; Ravasi; Hume (February 2004). “Interferon-gamma: an overview of signals, mechanisms and functions”. 《J. Leukoc. Biol.》 75 (2): 163–89. doi:10.1189/jlb.0603252. PMID 14525967. S2CID 15862242.
- ↑ Delves 등. 2006, 188쪽
- ↑ 가 나 Sompayrac 2019, 136쪽
- ↑ Lipu HN, Ahmed TA, Ali S, Ahmed D, Waqar MA; Ahmed; Ali; Ahmed; Waqar (September 2008). “Chronic granulomatous disease”. 《J Pak Med Assoc》 58 (9): 516–18. PMID 18846805.
- ↑ Kaplan J, De Domenico I, Ward DM; De Domenico; Ward (January 2008). “Chediak-Higashi syndrome”. 《Curr. Opin. Hematol.》 15 (1): 22–29. doi:10.1097/MOH.0b013e3282f2bcce. PMID 18043242. S2CID 43243529.
- ↑ Sompayrac 2019, 7쪽
- ↑ de Almeida SM, Nogueira MB, Raboni SM, Vidal LR; Nogueira; Raboni; Vidal (October 2007). “Laboratorial diagnosis of lymphocytic meningitis”. 《Braz J Infect Dis》 11 (5): 489–95. doi:10.1590/s1413-86702007000500010. PMID 17962876.
- ↑ Sompayrac 2019, 22쪽
- ↑ Sompayrac 2019, 68쪽
- ↑ “Apoptosis”. 《Merriam-Webster Online Dictionary》. 2014년 12월 19일에 확인함.
- ↑ Li MO, Sarkisian MR, Mehal WZ, Rakic P, Flavell RA; Sarkisian; Mehal; Rakic; Flavell (November 2003). “Phosphatidylserine receptor is required for clearance of apoptotic cells”. 《Science》 302 (5650): 1560–63. doi:10.1126/science.1087621. PMID 14645847. S2CID 36252352. (Free registration required for online access)
- ↑ Nagata S, Sakuragi T, Segawa K (December 2019). “Flippase and scramblase for phosphatidylserine exposure”. 《Current Opinion in Immunology》 62: 31–38. doi:10.1016/j.coi.2019.11.009. PMID 31837595.
- ↑ Wang X (2003). “Cell corpse engulfment mediated by C. elegans phosphatidylserine receptor through CED-5 and CED-12”. 《Science》 302 (5650): 1563–1566. Bibcode:2003Sci...302.1563W. doi:10.1126/science.1087641. PMID 14645848. S2CID 25672278. (Free registration required for online access)
- ↑ Savill J, Gregory C, Haslett C (2003). “Eat me or die”. 《Science》 302 (5650): 1516–17. doi:10.1126/science.1092533. hdl:1842/448. PMID 14645835. S2CID 13402617.
- ↑ Zhou Z, Yu X; Yu (October 2008). “Phagosome maturation during the removal of apoptotic cells: receptors lead the way”. 《Trends Cell Biol.》 18 (10): 474–85. doi:10.1016/j.tcb.2008.08.002. PMC 3125982. PMID 18774293.
- ↑ Sompayrac 2019, 3쪽
- ↑ Sompayrac 2019, 4쪽
- ↑ Sompayrac 2019, 27–35쪽
- ↑ Delves 등. 2006, 171–184쪽
- ↑ Delves 등. 2006, 456쪽
- ↑ Timothy Lee (2004). “Antigen Presenting Cells (APC)”. 《Immunology for 1st Year Medical Students》. Dalhousie University. 2008년 1월 12일에 원본 문서에서 보존된 문서. 2014년 12월 19일에 확인함.
- ↑ Delves 등. 2006, 161쪽
- ↑ Sompayrac 2019, 8쪽
- ↑ Delves 등. 2006, 237–242쪽
- ↑ Lange C, Dürr M, Doster H, Melms A, Bischof F; Dürr; Doster; Melms; Bischof (2007). “Dendritic cell-regulatory T-cell interactions control self-directed immunity”. 《Immunol. Cell Biol.》 85 (8): 575–81. doi:10.1038/sj.icb.7100088. PMID 17592494. S2CID 36342899.
- ↑ Steinman, Ralph M. (2004). “Dendritic Cells and Immune Tolerance”. The Rockefeller University. 2009년 3월 11일에 원본 문서에서 보존된 문서. 2014년 12월 19일에 확인함.
- ↑ Romagnani, S (2006). “Immunological tolerance and autoimmunity”. 《Internal and Emergency Medicine.》 1 (3): 187–96. doi:10.1007/BF02934736. PMID 17120464. S2CID 27585046.
- ↑ Sompayrac 2019, 16–17쪽
- ↑ Sompayrac 2019, 18–19쪽
- ↑ Delves 등. 2006, 6쪽
- ↑ Zen K, Parkos CA; Parkos (October 2003). “Leukocyte-epithelial interactions”. 《Curr. Opin. Cell Biol.》 15 (5): 557–64. doi:10.1016/S0955-0674(03)00103-0. PMID 14519390.
- ↑ Sompayrac 2019, 18쪽
- ↑ Hoffbrand, Pettit & Moss 2005, 117쪽
- ↑ Delves 등. 2006, 1–6쪽
- ↑ Sompayrac 2019, 136쪽
- ↑ Takahashi K, Naito M, Takeya M; Naito; Takeya (July 1996). “Development and heterogeneity of macrophages and their related cells through their differentiation pathways”. 《Pathol. Int.》 46 (7): 473–85. doi:10.1111/j.1440-1827.1996.tb03641.x. PMID 8870002. S2CID 6049656.
- ↑ Krombach F, Münzing S, Allmeling AM, Gerlach JT, Behr J, Dörger M; Münzing; Allmeling; Gerlach; Behr; Dörger (September 1997). “Cell size of alveolar macrophages: an interspecies comparison”. 《Environ. Health Perspect.》. 105 Suppl 5 (Suppl 5): 1261–63. doi:10.2307/3433544. JSTOR 3433544. PMC 1470168. PMID 9400735.
- ↑ 가 나 다 라 마 Delves 등. 2006, 31–36쪽
- ↑ Ernst & Stendahl 2006, 8쪽
- ↑ Delves 등. 2006, 156쪽
- ↑ Delves 등. 2006, 187쪽
- ↑ Stvrtinová, Viera; Ján Jakubovský and Ivan Hulín (1995). 〈Neutrophils, central cells in acute inflammation〉. 《Inflammation and Fever from Pathophysiology: Principles of Disease》. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press. ISBN 978-80-967366-1-4. 2010년 12월 31일에 원본 문서에서 보존된 문서. 2014년 12월 19일에 확인함.
- ↑ Delves 등. 2006, 4쪽
- ↑ 가 나 Sompayrac 2019, 18쪽
- ↑ Linderkamp O, Ruef P, Brenner B, Gulbins E, Lang F; Ruef; Brenner; Gulbins; Lang (December 1998). “Passive deformability of mature, immature, and active neutrophils in healthy and septicemic neonates”. 《Pediatr. Res.》 44 (6): 946–50. doi:10.1203/00006450-199812000-00021. PMID 9853933.
- ↑ Paoletti, Notario & Ricevuti 1997, 62쪽
- ↑ Soehnlein O, Kenne E, Rotzius P, Eriksson EE, Lindbom L; Kenne; Rotzius; Eriksson; Lindbom (January 2008). “Neutrophil secretion products regulate anti-bacterial activity in monocytes and macrophages”. 《Clin. Exp. Immunol.》 151 (1): 139–45. doi:10.1111/j.1365-2249.2007.03532.x. PMC 2276935. PMID 17991288.
- ↑ Soehnlein O, Kai-Larsen Y, Frithiof R (October 2008). “Neutrophil primary granule proteins HBP and HNP1-3 boost bacterial phagocytosis by human and murine macrophages”. 《J. Clin. Invest.》 118 (10): 3491–502. doi:10.1172/JCI35740. PMC 2532980. PMID 18787642.
- ↑ Papayannopoulos V (February 2018). “Neutrophil extracellular traps in immunity and disease”. 《Nature Reviews. Immunology》 18 (2): 134–147. doi:10.1038/nri.2017.105. PMID 28990587.
- ↑ Steinman RM, Cohn ZA; Cohn (1973). “Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution”. 《J. Exp. Med.》 137 (5): 1142–62. doi:10.1084/jem.137.5.1142. PMC 2139237. PMID 4573839.
- ↑ 가 나 Steinman, Ralph. “Dendritic Cells”. The Rockefeller University. 2009년 6월 27일에 원본 문서에서 보존된 문서. 2014년 12월 19일에 확인함.
- ↑ Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S; Valladeau; Zitvogel; Théry; Amigorena (2002). “Antigen presentation and T cell stimulation by dendritic cells”. 《Annu. Rev. Immunol.》 20: 621–67. doi:10.1146/annurev.immunol.20.100301.064828. PMID 11861614.
- ↑ Hoffbrand, Pettit & Moss 2005, 134쪽
- ↑ Sallusto F, Lanzavecchia A; Lanzavecchia (2002). “The instructive role of dendritic cells on T-cell responses”. 《Arthritis Res.》. 4 Suppl 3 (Suppl 3): S127–32. doi:10.1186/ar567. PMC 3240143. PMID 12110131.
- ↑ Sompayrac 2019, 45–46쪽
- ↑ Novak N, Bieber T, Peng WM; Bieber; Peng (2010). “The immunoglobulin E-Toll-like receptor network”. 《International Archives of Allergy and Immunology》 151 (1): 1–7. doi:10.1159/000232565. PMID 19672091. 2014년 12월 19일에 확인함.
- ↑ Kalesnikoff J, Galli SJ; Galli (November 2008). “New developments in mast cell biology”. 《Nature Immunology》 9 (11): 1215–23. doi:10.1038/ni.f.216. PMC 2856637. PMID 18936782.
- ↑ 가 나 Malaviya R, Abraham SN; Abraham (February 2001). “Mast cell modulation of immune responses to bacteria”. 《Immunol. Rev.》 179: 16–24. doi:10.1034/j.1600-065X.2001.790102.x. PMID 11292019. S2CID 23115222.
- ↑ Connell I, Agace W, Klemm P, Schembri M, Mărild S, Svanborg C; Agace; Klemm; Schembri; Mărild; Svanborg (September 1996). “Type 1 fimbrial expression enhances Escherichia coli virulence for the urinary tract”. 《Proc. Natl. Acad. Sci. U.S.A.》 93 (18): 9827–32. Bibcode:1996PNAS...93.9827C. doi:10.1073/pnas.93.18.9827. PMC 38514. PMID 8790416.
- ↑ Malaviya R, Twesten NJ, Ross EA, Abraham SN, Pfeifer JD; Twesten; Ross; Abraham; Pfeifer (February 1996). “Mast cells process bacterial Ags through a phagocytic route for class I MHC presentation to T cells”. 《J. Immunol.》 156 (4): 1490–96. PMID 8568252. 2014년 12월 19일에 확인함.
- ↑ Taylor ML, Metcalfe DD; Metcalfe (2001). “Mast cells in allergy and host defense”. 《Allergy Asthma Proc》 22 (3): 115–19. doi:10.2500/108854101778148764. PMID 11424870.
- ↑ Urb M, Sheppard DC (2012). “The role of mast cells in the defence against pathogens”. 《PLOS Pathogens》 8 (4): e1002619. doi:10.1371/journal.ppat.1002619. PMC 3343118. PMID 22577358.
- ↑ 가 나 Paoletti, Notario & Ricevuti 1997, 427쪽
- ↑ Birge RB, Ucker DS; Ucker (July 2008). “Innate apoptotic immunity: the calming touch of death”. 《Cell Death Differ.》 15 (7): 1096–1102. doi:10.1038/cdd.2008.58. PMID 18451871.
- ↑ Couzinet S, Cejas E, Schittny J, Deplazes P, Weber R, Zimmerli S; Cejas; Schittny; Deplazes; Weber; Zimmerli (December 2000). “Phagocytic uptake of Encephalitozoon cuniculi by nonprofessional phagocytes”. 《Infect. Immun.》 68 (12): 6939–45. doi:10.1128/IAI.68.12.6939-6945.2000. PMC 97802. PMID 11083817.
- ↑ Segal G, Lee W, Arora PD, McKee M, Downey G, McCulloch CA; Lee; Arora; McKee; Downey; McCulloch (January 2001). “Involvement of actin filaments and integrins in the binding step in collagen phagocytosis by human fibroblasts”. 《Journal of Cell Science》 114 (Pt 1): 119–129. doi:10.1242/jcs.114.1.119. PMID 11112696.
- ↑ Rabinovitch M (March 1995). “Professional and non-professional phagocytes: an introduction”. 《Trends Cell Biol.》 5 (3): 85–87. doi:10.1016/S0962-8924(00)88955-2. PMID 14732160.
- ↑ Lin A, Loré K (2017). “Granulocytes: New Members of the Antigen-Presenting Cell Family”. 《Frontiers in Immunology》 8: 1781. doi:10.3389/fimmu.2017.01781. PMC 5732227. PMID 29321780.
- ↑ 가 나 다 라 마 바 Todar, Kenneth. “Mechanisms of Bacterial Pathogenicity: Bacterial Defense Against Phagocytes”. 2008. 2014년 12월 19일에 확인함.
- ↑ Alexander J, Satoskar AR, Russell DG; Satoskar; Russell (September 1999). “Leishmania species: models of intracellular parasitism”. 《J. Cell Sci.》 112 (18): 2993–3002. doi:10.1242/jcs.112.18.2993. PMID 10462516. 2014년 12월 19일에 확인함.
- ↑ Celli J, Finlay BB; Finlay (May 2002). “Bacterial avoidance of phagocytosis”. 《Trends Microbiol.》 10 (5): 232–37. doi:10.1016/S0966-842X(02)02343-0. PMID 11973157.
- ↑ Valenick LV, Hsia HC, Schwarzbauer JE; Hsia; Schwarzbauer (September 2005). “Fibronectin fragmentation promotes alpha4beta1 integrin-mediated contraction of a fibrin-fibronectin provisional matrix”. 《Experimental Cell Research》 309 (1): 48–55. doi:10.1016/j.yexcr.2005.05.024. PMID 15992798.
- ↑ Burns SM, Hull SI; Hull (August 1999). “Loss of resistance to ingestion and phagocytic killing by O(-) and K(-) mutants of a uropathogenic Escherichia coli O75:K5 strain”. 《Infect. Immun.》 67 (8): 3757–62. doi:10.1128/IAI.67.8.3757-3762.1999. PMC 96650. PMID 10417134.
- ↑ Vuong C, Kocianova S, Voyich JM (December 2004). “A crucial role for exopolysaccharide modification in bacterial biofilm formation, immune evasion, and virulence”. 《J. Biol. Chem.》 279 (52): 54881–86. doi:10.1074/jbc.M411374200. PMID 15501828.
- ↑ Melin M, Jarva H, Siira L, Meri S, Käyhty H, Väkeväinen M; Jarva; Siira; Meri; Käyhty; Väkeväinen (February 2009). “Streptococcus pneumoniae capsular serotype 19F is more resistant to C3 deposition and less sensitive to opsonophagocytosis than serotype 6B”. 《Infect. Immun.》 77 (2): 676–84. doi:10.1128/IAI.01186-08. PMC 2632042. PMID 19047408.
- ↑ 가 나 Foster TJ (December 2005). “Immune evasion by staphylococci”. 《Nat. Rev. Microbiol.》 3 (12): 948–58. doi:10.1038/nrmicro1289. PMID 16322743. S2CID 205496221.
- ↑ Fällman M, Deleuil F, McGee K (February 2002). “Resistance to phagocytosis by Yersinia”. 《International Journal of Medical Microbiology》 291 (6–7): 501–9. doi:10.1078/1438-4221-00159. PMID 11890550.
- ↑ Sansonetti P (December 2001). “Phagocytosis of bacterial pathogens: implications in the host response”. 《Semin. Immunol.》 13 (6): 381–90. doi:10.1006/smim.2001.0335. PMID 11708894.
- ↑ Dersch P, Isberg RR; Isberg (March 1999). “A region of the Yersinia pseudotuberculosis invasin protein enhances integrin-mediated uptake into mammalian cells and promotes self-association”. 《EMBO J.》 18 (5): 1199–1213. doi:10.1093/emboj/18.5.1199. PMC 1171211. PMID 10064587.
- ↑ Antoine JC, Prina E, Lang T, Courret N; Prina; Lang; Courret (October 1998). “The biogenesis and properties of the parasitophorous vacuoles that harbour Leishmania in murine macrophages”. 《Trends Microbiol.》 6 (10): 392–401. doi:10.1016/S0966-842X(98)01324-9. PMID 9807783.
- ↑ Das D, Saha SS, Bishayi B; Saha; Bishayi (July 2008). “Intracellular survival of Staphylococcus aureus: correlating production of catalase and superoxide dismutase with levels of inflammatory cytokines”. 《Inflamm. Res.》 57 (7): 340–49. doi:10.1007/s00011-007-7206-z. PMID 18607538. S2CID 22127111.
- ↑ Hara H, Kawamura I, Nomura T, Tominaga T, Tsuchiya K, Mitsuyama M; Kawamura; Nomura; Tominaga; Tsuchiya; Mitsuyama (August 2007). “Cytolysin-dependent escape of the bacterium from the phagosome is required but not sufficient for induction of the Th1 immune response against Listeria monocytogenes infection: distinct role of Listeriolysin O determined by cytolysin gene replacement”. 《Infect. Immun.》 75 (8): 3791–3801. doi:10.1128/IAI.01779-06. PMC 1951982. PMID 17517863.
- ↑ Datta V, Myskowski SM, Kwinn LA, Chiem DN, Varki N, Kansal RG, Kotb M, Nizet V; Myskowski; Kwinn; Chiem; Varki; Kansal; Kotb; Nizet (May 2005). “Mutational analysis of the group A streptococcal operon encoding streptolysin S and its virulence role in invasive infection”. 《Mol. Microbiol.》 56 (3): 681–95. doi:10.1111/j.1365-2958.2005.04583.x. PMID 15819624. S2CID 14748436.
- ↑ Iwatsuki K, Yamasaki O, Morizane S, Oono T; Yamasaki; Morizane; Oono (June 2006). “Staphylococcal cutaneous infections: invasion, evasion and aggression”. 《J. Dermatol. Sci.》 42 (3): 203–14. doi:10.1016/j.jdermsci.2006.03.011. PMID 16679003.
- ↑ 가 나 Denkers EY, Butcher BA; Butcher (January 2005). “Sabotage and exploitation in macrophages parasitized by intracellular protozoans”. 《Trends Parasitol.》 21 (1): 35–41. doi:10.1016/j.pt.2004.10.004. PMID 15639739.
- ↑ Gregory DJ, Olivier M; Olivier (2005). “Subversion of host cell signalling by the protozoan parasite Leishmania”. 《Parasitology》. 130 Suppl: S27–35. doi:10.1017/S0031182005008139. PMID 16281989. S2CID 24696519.
- ↑ Paoletti, Notario & Ricevuti 1997, 426–430쪽
- ↑ Heinzelmann M, Mercer-Jones MA, Passmore JC; Mercer-Jones; Passmore (August 1999). “Neutrophils and renal failure”. 《Am. J. Kidney Dis.》 34 (2): 384–99. doi:10.1016/S0272-6386(99)70375-6. PMID 10430993.
- ↑ Lee WL, Downey GP; Downey (February 2001). “Neutrophil activation and acute lung injury”. 《Curr Opin Crit Care》 7 (1): 1–7. doi:10.1097/00075198-200102000-00001. PMID 11373504. S2CID 24164360.
- ↑ 가 나 Moraes TJ, Zurawska JH, Downey GP; Zurawska; Downey (January 2006). “Neutrophil granule contents in the pathogenesis of lung injury”. 《Curr. Opin. Hematol.》 13 (1): 21–27. doi:10.1097/01.moh.0000190113.31027.d5. PMID 16319683. S2CID 29374195.
- ↑ Abraham E (April 2003). “Neutrophils and acute lung injury”. 《Crit. Care Med.》 31 (4 Suppl): S195–99. doi:10.1097/01.CCM.0000057843.47705.E8. PMID 12682440. S2CID 4004607.
- ↑ Ricevuti G (December 1997). “Host tissue damage by phagocytes”. 《Ann. N. Y. Acad. Sci.》 832 (1): 426–48. Bibcode:1997NYASA.832..426R. doi:10.1111/j.1749-6632.1997.tb46269.x. PMID 9704069. S2CID 10318084.
- ↑ Charley B, Riffault S, Van Reeth K; Riffault; Van Reeth (October 2006). “Porcine innate and adaptative immune responses to influenza and coronavirus infections”. 《Ann. N. Y. Acad. Sci.》 1081 (1): 130–36. Bibcode:2006NYASA1081..130C. doi:10.1196/annals.1373.014. hdl:1854/LU-369324. PMC 7168046. PMID 17135502.
- ↑ Sompayrac 2019, 2쪽
- ↑ 가 나 Cosson P, Soldati T; Soldati (June 2008). “Eat, kill or die: when amoeba meets bacteria”. 《Curr. Opin. Microbiol.》 11 (3): 271–76. doi:10.1016/j.mib.2008.05.005. PMID 18550419.
- ↑ Bozzaro S, Bucci C, Steinert M; Bucci; Steinert (2008). 《Phagocytosis and host-pathogen interactions in Dictyostelium with a look at macrophages》. 《Int Rev Cell Mol Biol》. International Review of Cell and Molecular Biology 271. 253–300쪽. doi:10.1016/S1937-6448(08)01206-9. ISBN 9780123747280. PMID 19081545.
- ↑ Chen G, Zhuchenko O, Kuspa A; Zhuchenko; Kuspa (August 2007). “Immune-like phagocyte activity in the social amoeba”. 《Science》 317 (5838): 678–81. Bibcode:2007Sci...317..678C. doi:10.1126/science.1143991. PMC 3291017. PMID 17673666.
- ↑ Delves 등. 2006, 251–252쪽
- ↑ Hanington PC, Tam J, Katzenback BA, Hitchen SJ, Barreda DR, Belosevic M; Tam; Katzenback; Hitchen; Barreda; Belosevic (April 2009). “Development of macrophages of cyprinid fish”. 《Dev. Comp. Immunol.》 33 (4): 411–29. doi:10.1016/j.dci.2008.11.004. PMID 19063916.
참고 문헌
편집- Delves, P. J.; Martin, S. J.; Burton, D. R.; Roit, I. M. (2006). 《Roitt's Essential Immunology》 11판. Malden, MA: Blackwell Publishing. ISBN 978-1-4051-3603-7.
- Ernst, J. D.; Stendahl, O., 편집. (2006). 《Phagocytosis of Bacteria and Bacterial Pathogenicity》. New York: Cambridge University Press. ISBN 978-0-521-84569-4. Website
- Hoffbrand, A. V.; Pettit, J. E.; Moss, P. A. H. (2005). 《Essential Haematology》 4판. London: Blackwell Science. ISBN 978-0-632-05153-3.
- Paoletti, R.; Notario, A.; Ricevuti, G., 편집. (1997). 《Phagocytes: Biology, Physiology, Pathology, and Pharmacotherapeutics》. New York: The New York Academy of Sciences. ISBN 978-1-57331-102-1.
- Robinson, J. P.; Babcock, G. F., 편집. (1998). 《Phagocyte Function — A guide for research and clinical evaluation》. New York: Wiley–Liss. ISBN 978-0-471-12364-4.
- Sompayrac, L. (2019). 《How the Immune System Works》 6판. Malden, MA: Blackwell Publishing. ISBN 978-1-119-54212-4.
외부 링크
편집- 위키미디어 공용에 식세포 관련 미디어 분류가 있습니다.
- 의학주제표목 (MeSH)의 Phagocytes
- 세균을 포식하는 백혈구 (유튜브 영상)